
【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
【答案】+92.1 kJ/mol < cd 0.067 mol/(Lmin) 6.25 正向 B
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
(2)①温度对平衡的影响因素为温度升高,化学平衡向吸热方向移动,如果正向移动,反应物的转化率会升高;
②a.平衡常数表示反应进行的程度,当平衡正向移动时平衡常数增大;
b.达平衡后再充入稀有气体,压强增大,但不影响反应物和生成物的浓度,平衡不移动;
c.反应CO(g)+2H2(g)![]() CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化;
CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化;
d.在恒温恒容的条件下,增大压强,平衡向气体总物质的量减小的方向移动;
③先根据图表计算在03 min内CH3OH的变化浓度,再利用公式v=![]() 计算03 min内v(CH3OH);
计算03 min内v(CH3OH);
④结合平衡状态时各种物质的浓度计算平衡常数K,向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,根据此时浓度计算Qc=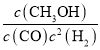 ,再比较Qc与K的关系判断平衡移动方向;
,再比较Qc与K的关系判断平衡移动方向;
(3)甲为恒温恒容,乙为恒温恒压,正反应是气体体积减小的反应,平衡时混合气体物质的量减小,则平衡时甲中压强小于乙中压强,乙中平衡等效为在甲中平衡基础上增大压强,平衡正向移动。
(1)①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
根据盖斯定律计算[①-(②+③)×6]×![]() ,得到NH3分解为N2和H2的热化学方程式:2NH3(g)
,得到NH3分解为N2和H2的热化学方程式:2NH3(g)![]() N2(g)+3H2(g) △H=+92.1 kJ/mol;
N2(g)+3H2(g) △H=+92.1 kJ/mol;
(2)①由图示可知在恒压条件下,随着温度的升高,CO的转化率降低,说明升高温度平衡逆向移动,逆反应为吸热反应,所以该反应的正反应为放热反应,△H2<0;
②a.反应CO(g)+2H2(g)![]() CH3OH(g)正方向为放热反应,升高温度平衡逆向移动,化学平衡常数减小,a错误;
CH3OH(g)正方向为放热反应,升高温度平衡逆向移动,化学平衡常数减小,a错误;
b.达平衡后再充入稀有气体,压强增大,但由于反应体系中任何一种物质的浓度不变,所以化学平衡不移动,CO的转化率不变,b错误;
c.反应CO(g)+2H2(g)![]() CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,c正确;
CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,c正确;
d.该反应的正反应物是气体体积减小的反应,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,d正确;
故合理选项是cd;
③根据图示可知:在03 min内H2的物质的量变化4.0 mol,则会同时消耗2.0 mol CO,反应产生2.0 mol CH3OH,则v(CH3OH)=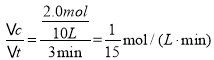 =0.067 mol/(Lmin);
=0.067 mol/(Lmin);
④由③可知反应在3 min时已经达到平衡状态,此时c(H2)=(8.0-4.0)mol÷10 L=0.4 mol/L,c(CO)=0.2 mol/L,c(CH3OH)=0.2 mol/L,则根据平衡常数含义,可得200℃时平衡常数K=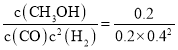 =6.25;向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,此时各物质的浓度为c(CO)=0.2 mol/L,c(H2)=0.6 mol/L,c(CH3OH)=0.4 mol/L,保持温度不变,则化学平衡不变,此时Qc=
=6.25;向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,此时各物质的浓度为c(CO)=0.2 mol/L,c(H2)=0.6 mol/L,c(CH3OH)=0.4 mol/L,保持温度不变,则化学平衡不变,此时Qc=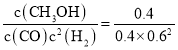 =2.78<6.25=K,则此时平衡应向正反应方向移动;
=2.78<6.25=K,则此时平衡应向正反应方向移动;
(3)甲为恒温恒容,乙为恒温恒压,由于该反应的正反应是气体体积减小的反应,平衡时混合气体物质的量减小,则平衡时甲中压强小于乙中压强,乙中平衡等效为在甲中平衡基础上增大压强,增大压强,化学平衡正向移动,则乙的SO2的转化率将大于甲的SO2的转化率,若甲容器中SO2的转化率为p%,所以乙中容器中SO2的转化率大于P%,故合理选项是B。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在玻璃生产中,熔炉里原料发生的主要反应为:2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2↑
2Na2SiO3+CaSiO3+CO2↑
(1)某反应物在熔融状态下不导电,它属于___晶体。
(2)上述反应里所涉及的短周期元素原子半径由大到小的顺序为___。
(3)碳和硅属于同族元素,该族元素的原子最外层轨道表示式为___。
(4)写一个能比较碳元素和氧元素非金属性强弱的化学反应方程式:___。
(5)CO2的电子式为___。
(6)反应物Na2CO3和CaCO3均能制备二氧化碳,但是往往不是都能使用稀硫酸,请说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用SO2除去原料气中少量CO生成物为S和氧和CO2。
(1)写出该反应的化学方程式为__________________________________________
(2)上述反应中,每减少2.24L气体(标准状况下)转移电子数为________________。
(3)上述反应所涉及的三种元素中原子半径从大到小的排列顺序为______________;三种元素非金属性由强到弱的顺序为__________________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_________种不同运动状态的电子,有_________种能量不同的电子,写出铝在元素周期表中的位置:________
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是________晶体,试比较组成该物质的两微粒半径大小:_______
(3)可用铝和氧化钡反应可制备金属钡:4BaO+2Al![]() BaO·Al2O3+3Ba↑的主要原因是_______(选填编号)。
BaO·Al2O3+3Ba↑的主要原因是_______(选填编号)。
a.Al活泼性大于Ba b.Ba沸点比Al的低 c.BaO·Al2O3比Al2O3稳定
(4)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_________(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(5)描述工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
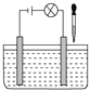
A.盐酸中逐滴加入食盐溶液
B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见如图。有关说法错误的是( )

A.晶体中碳原子键全部是碳碳单键
B.石墨烯与金刚石都是碳的同素异形体
C.石墨烯中所有碳原子可以处于同一个平面
D.从石墨中剥离得到石墨烯需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36g炭不完全燃烧所得气体中CO和CO2的体积比为1:2。已知:
C(s)+1/2O2(g) === CO(g); △H1=-110.35kJ/mol
CO(g)+1/2O2(g) === CO2(g);△H2=-282.57kJ/mol
则与36g炭完全燃烧相比,损失的热量是( )
A.392.93kJB.282.57kJC.784.92kJD.3274.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为436kJ,1molO=O键断裂时吸收热量为496kJ,则水蒸气中1molH-O键形成时放出的热量为_____。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在常温下发生水解时,对应的离子方程式正确的是
①NaHCO3:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
②NH4Cl:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
③CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
④NaF:F-+H2O===HF+OH-
A. ①②B. ②③C. ①③D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com