
【题目】一定量的混合气体在密闭容器中发生如下反应:![]() ,达到平衡后测得A气体的浓度为
,达到平衡后测得A气体的浓度为![]() ,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.平衡向正反应方向移动B.![]()
C.B的物质的量浓度减小D.C的体积分数降低
【答案】A
【解析】
保持温度不变,保持温度不变将容器的容积缩为原来的一半,如平衡不移动,A的浓度为1mol/L,实际上A的浓度变为0.8mol/L,说明平衡向消耗A的方向移动,即向正反应移动,
A、由上述分析可知,平衡向正反应方向移动,选项A正确;
B、缩小体积,压强增大,平衡向正反应移动,压强增大平衡向气体物质的量减小的方向移动,即x+y>n,选项B错误;
C、由上述分析可知,平衡虽然向正反应方向移动,B的量减小,但容器的体积缩小一半,故B的物质的量浓度比原来的大,但小于原来浓度的2倍,选项C错误;
D、平衡向正反应方向移动,气体C的物质的量增大,故C的体积分数增大,选项D错误;
答案选A。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
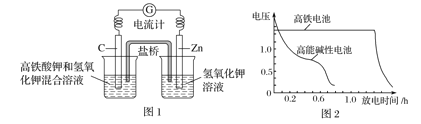
①该电池放电时正极产生红褐色物质,写出正极的电极反应式为_________。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____________。
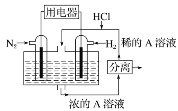
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是_____,A是________。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 环已烷与苯可用酸性KMnO4溶液鉴别
B. 在一定条件下,苯与液溴、硝酸、氢气作用生成溴苯、硝基苯、环己烷的反应都属于取代反应
C. 分子式为C8H10O的某芳香化合物有多种结构,其中含有-CH2OH基团的有4种
D. 异丙苯(![]() )中碳原子可能都处于同一平面
)中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为___,检验a电极上产生的气体的方法是__,甲电池的总反应化学方程式是___。
(2)在粗铜的电解过程中,图中c电极的材料是___ (填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为___;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属),则e电极的材料是___ (填“铁制品”或“镍块”,下同),f电极的材料是____。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:

(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 水电离的![]() =1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
=1×10-13mol/L的溶液:K+、Na+、AlO2—、CO32—
B. ![]() =1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
=1×10-12mol/L的溶液中:Cu2+、NH4+、Cl-、NO3-
C. 与Al反应能放出H2的溶液:Cu2+、NO3—、K+、SO42—
D. 无色溶液中:Cr2O72—、Na+、H+、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com