
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
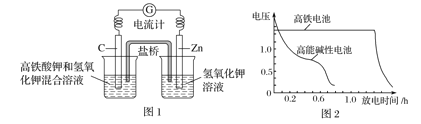
①该电池放电时正极产生红褐色物质,写出正极的电极反应式为_________。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____________。
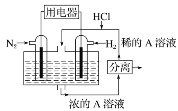
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是_____,A是________。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________。

【答案】FeO42-+4H2O+3e-═Fe(OH)3↓+5OH- 右 左 使用时间长、工作电压稳定 N2+8H++6e-=2NH4+ NH4Cl b到a CO-2e-+O2-=CO2
【解析】
(1)①根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3;②原电池工作时,阴离子向原电池负极移动,阳离子向正移动;③根据图像从使用时间的长短和工作电压角度分析解答;
(2)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,据此写出正极的电极反应式;生成的铵根离子与溶液中的氯化氢结合生成氯化铵;
(3)原电池放电时电子从负极流向正极,阴离子向负极移动,负极上一氧化碳失电子和氧离子反应生成二氧化碳。
(1)①根据电池装置示意图,Zn做负极,C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极的电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;
②盐桥中阴离子向原电池负极移动。盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,若用阳离子交换膜代替盐桥,则钾离子(阳离子)向左移动,故答案为:右;左;
③由图可知高铁电池的优点有:使用时间长、工作电压稳定,故答案为:使用时间长、工作电压稳定;
(2)该电池的本质是合成氨反应,所以正极上是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与溶液中的氯化氢结合生成氯化铵,所以A是NH4Cl,故答案为:N2+8H++6e-=2NH4+;NH4Cl;
(3)依据图可知:一氧化碳-空气形成燃料电池,一氧化碳失电子和氧离子反应生成二氧化碳,发生氧化反应,电极反应式CO-2e-+O2-=CO2,所以一氧化碳所在极为负极,通入空气的一极为正极,原电池放电时电子从负极流向正极,阴离子向负极移动,所以工作时O2-的移动方向从b到a,故答案为:b到a;CO-2e-+O2-=CO2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下,关于pH=11的NH3·H2O溶液,下列分析正确的是
A. c(NH3·H2O)=10-3mol/L
B. 由水电离出的c(H+)=10-11 mol/L
C. 加入少量 NH4Cl固体,NH3·H2O的电离平衡逆向移动,KW值减小
D. 加入等体积 pH=3的盐酸,所得溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。

下列说法正确的是
A.室温时,HA的电离度约为10-6
B.图中B点时,溶液的Kw略大于1×10-14
C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-)
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粗氧化镍(主要含NO、CoO等)为原料制备纯镍,先用CO还原粗氧化镍制备羰化镍,羰化后的产物为Co2(CO)8、Ni(CO)4已知反应为:
①CO2(g)+C(s)2CO(g)△H
②Ni(s)+4CO(g)Ni(CO)4(g)△H<0.
Ni(CO)4的沸点43.2℃,熔点﹣19.3℃,分解温度135℃;Co2(CO)8沸点72℃,熔点31℃。下列有关叙述中不正确的是( )

A.①反应在900℃进行,温度升高,K增大,说明正反应△H>0
B.蒸馏提取Ni(CO)4应选择的适宜温度范围是43.2℃﹣72℃
C.蒸馏后采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳
D.提纯粗镍若简化为图装置,则温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
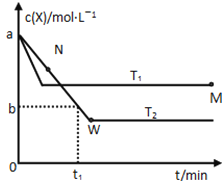
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:

则x=__________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。

①a、b两点的反应速率:v(a)______v(b)(填“>”、“<”、“=”)
②T1______T2 (填“>”、“<”、“=”),原因是_________________________。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________,A元素在元素周期表中的位置是__________,B原子的结构示意图为__________,A、B、C、D四种元素的离子半径从大到小的顺序是__________(用离子符号表示)。
(2)单质A有两种同素异形体,其中沸点高的是_____(填分子式),原因是_______;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为___,中心原子的杂化轨道类型为___。
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为______
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F的化学式为_____:晶胞中A 原子的配位数为______;列出晶体F的密度(g.cm-3)计算式_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:![]() ,达到平衡后测得A气体的浓度为
,达到平衡后测得A气体的浓度为![]() ,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为
,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.平衡向正反应方向移动B.![]()
C.B的物质的量浓度减小D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com