
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:

则x=__________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。

①a、b两点的反应速率:v(a)______v(b)(填“>”、“<”、“=”)
②T1______T2 (填“>”、“<”、“=”),原因是_________________________。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】1076 < < 该反应是放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小,故Tl<T2 bc 16/MPa2
【解析】
(1)根据反应热=反应物的总键能-生成物的总键能计算;
(2)①压强越大,反应速率越快;②压强相同时,一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,结合温度对平衡的影响分析判断;③根据化学平衡时正逆反应速率相等,各物质含量不再改变分析判断;④结合三段式列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算。
(1)反应热=反应物的总键能-生成物的总键能,则△H=2×436 kJ/mol +x kJ/mol -343 kJ/mol -413 kJ/mol×3-465 kJ/mol =-99 kJ/mol,解得x=1076,故答案为:1076;
(2)①压强越大,反应速率越快,所以a、b两点的反应速率:v(a)<v(b),故答案为:<;
②CO(g)+2H2(g)![]() CH3OH(g) H1<0,是放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;故答案为:<;该反应是放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
CH3OH(g) H1<0,是放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;故答案为:<;该反应是放热反应,升高温度,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.H2的消耗速率是CH3OH生成速率的2倍,均表示正反应速率,不能说明正、逆反应速率相等,不能说明达到平衡状态,故a错误;b.CH3OH的体积分数随着反应的进行增大,CH3OH的体积分数不再改变,说明达到平衡状态,故b正确;c.混合气体的总质量不变,容器可变,则混合气体的体积减小,密度增大,当混合气体的密度不再改变时,达到平衡状态,故c正确;d.根据C守恒,CO和CH3OH的物质的量之和始终保持不变,不能说明化学平衡,故d错误;故答案为:bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)CH3OH(g)
起始量(mol)1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,混合气体的总物质的量=1mol+2mol-2x=3mol-2×0.5mol=2mol,Kp=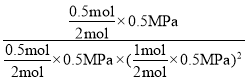 =16/MPa2,故答案为:16/MPa2。
=16/MPa2,故答案为:16/MPa2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】H1N1病毒是一种病毒。研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将H1N1病毒杀灭。氯气与氢氧化钙溶液充分反应,得到以次氯酸钙[Ca(ClO)2]为主要成分的漂粉精,其稳定性比漂白粉高。将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为______________________________。另取少许上层清液,先滴加适量的硝酸酸化,再滴加________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学知识回答下列问题:
(1)配制FeCl3水溶液时,常加入少量_____溶液,结合离子方程式解释原因:______。
(2)工业冶炼镁的化学方程式:_____。由氯化镁溶液制备无水氯化镁的操作是_____。
(3)锅炉水垢中的CaSO4可先用Na2CO3溶液浸泡一段时间,放出浸泡液后,再用盐酸处理,用离子方程式表示过程中发生的化学反应:_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.小苏打溶液与少量澄清石灰水混合:Ca2++OH-+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
B.AlCl3溶液中加入足量的氨水:Al3++4OH-=![]() +2H2O
+2H2O
C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D.钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
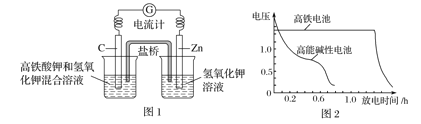
①该电池放电时正极产生红褐色物质,写出正极的电极反应式为_________。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____________。
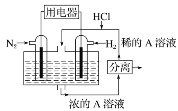
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是_____,A是________。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如下图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)2NH3(g)
①在反应体系中加入催化剂,反应速率______,该反应的反应热_______(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=_________,H2的转化率为______(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是________。
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)4NH3(g)+3O2(g) H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 环已烷与苯可用酸性KMnO4溶液鉴别
B. 在一定条件下,苯与液溴、硝酸、氢气作用生成溴苯、硝基苯、环己烷的反应都属于取代反应
C. 分子式为C8H10O的某芳香化合物有多种结构,其中含有-CH2OH基团的有4种
D. 异丙苯(![]() )中碳原子可能都处于同一平面
)中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用 0.20molL-1的氢氧化钠溶液![]() 指示剂为酚酞
指示剂为酚酞![]() 作为标准液来滴定。造成测定结果偏高的原因可能是
作为标准液来滴定。造成测定结果偏高的原因可能是 ![]()
![]()
A.用固体氢氧化钠配制标准溶液时其中混有![]() 杂质
杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现碱式滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com