
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
【答案】C
【解析】
A.由图可知,t2时刻,改变条件,正、逆反应速率同等程度增大,平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是改变压强,故改变条件为使用催化剂,故A正确,不符合题意;
B.t3时刻,改变条件,正、逆反应速率降低,且逆反应速率降低更多,平衡向正反应移动,该反应正反应是放热反应,温度降低,平衡向正反应移动,故可能为降低温度,故B正确,不符合题意;
C.t5时刻,改变条件,正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是改变压强,该反应正反应是放热反应,升高温度,平衡向逆反应移动,故改变条件为升高温度,故C错误,符合题意;
D.t2时刻,使用催化剂,平衡不移动,X的转化率不变,t3时刻,降低温度,平衡向正反应移动,X的转化率增大,t5时刻,升高温度,平衡向逆反应移动,X的转化率降低,则t4~t5内转化率最高,故D正确,不符合题意;
本题答案选C。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
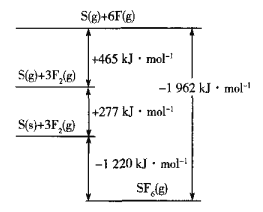
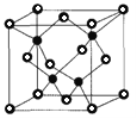
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素Q、W、X、Y、Z,位于不同主族,原子序数依次增大。
①W的氢化物与最高价氧化物对应水化物反应生成盐甲
②X、Y、Z的最高价氧化物对应水化物之间两两反应生成均可生成盐和水
③化合物X2O2可与Q的某种气态氧化物(标准状况下密度为1.25gL-1)在一定条件下发生化合反应,生成一种正盐乙
请回答下列各题:
(1)已知:ZO3n-+M2++H+→Z―+M4++H2O(M为金属元素,方程式未配平),则Z原子的结构示意图为___,n=___
(2)过程③的化学方程式为___。
(3)甲的水溶液呈___性(填“酸”、“碱”或“中”),原因是___(用离子方程式表示)。
(4)将Y单质粉末加入到盐乙的浓溶液中,缓慢放出气泡,加热后有大量气泡生成,同时生成白色沉淀丙。经检验气体是由单质A和少量Q的最高价氧化物组成。下列有关说法正确的是___。
A.Q元素是形成化合物种类最多的元素
B.单质A是热值最高的物质
C.白色沉淀丙既可溶于稀盐酸,也能溶于NaOH
D.白色沉淀丙可能是由生成的YO2-离子与溶液中存在的某种离子反应生成
(5)Y可形成三元半导体CuYO2,此三元半导体难溶于水,可溶于稀硝酸,且有NO生成,写出溶解过程的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9ClO能与Na反应放出氢气的共有![]() 不考虑立体异构
不考虑立体异构![]() ( )
( )
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式和离子方程式书写不正确的是( )
A. 甲苯和液溴可以发生如下的反应:![]() +Br2
+Br2![]()
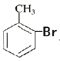 +HBr
+HBr
B. 甲酸溶液与足量的银氨溶液共热的化学方程式:HCOOH +2Ag(NH3)2OH![]() (NH4)2CO3+H2O+ 2Ag↓ +3NH3
(NH4)2CO3+H2O+ 2Ag↓ +3NH3
C. 苯酚钠溶液中通入少量二氧化碳反应的离子方程式:![]()
D. 尼泊金酸(![]() )与碳酸氢钠溶液反应的离子方程式
)与碳酸氢钠溶液反应的离子方程式![]() +HCO3-→
+HCO3-→![]() +H2O+CO2↑
+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 常温下电离常数为![]() 的酸HA溶液中
的酸HA溶液中![]()
B. 向0.1![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中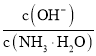 增大
增大
C. 将饱和![]() 溶液加入到饱和石灰水中,有白色沉淀产生,说明
溶液加入到饱和石灰水中,有白色沉淀产生,说明![]() 大于
大于![]()
D. 0.2![]() 溶液与0.1
溶液与0.1![]() 溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某样品甲为仅含有三种元素的纯净物,不溶于水,能溶于稀盐酸,为探究其组成和性质,设计并完成如下实验:
①将 21.5g 该物质溶解于 600mL 1mol·L-1 盐酸中,得到黄色溶液乙,将溶液乙分成两等份;
②将其中一份加热蒸干、灼烧,得到 8.0g 红棕色固体丙;
③向另一份溶液中加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥得到白色沉淀 57.4g。请回答:
(1)写出实验③中检出离子的结构示意图_____。
(2)样品甲中所含的三种元素为_____。
(3)写出实验①中反应的离子方程式_____。
(4)写出实验②中,检出固体丙中所含阳离子的实验方法_____。(写出实验操作、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为:
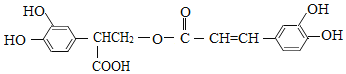
以邻苯二酚为原料合成迷迭香酸的路线为:
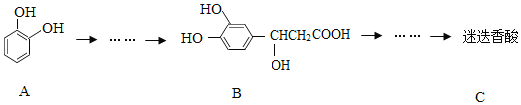
下列说法错误的是( )
A. 有机物B可以发生取代、加成、消去、氧化反应
B. 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH
C. 迷迭香酸在稀硫酸催化下水解的一种产物可由B转化得到
D. 有机物A分子中所有原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
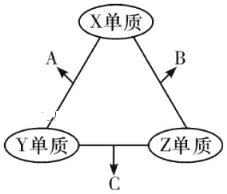
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com