
【题目】已知某样品甲为仅含有三种元素的纯净物,不溶于水,能溶于稀盐酸,为探究其组成和性质,设计并完成如下实验:
①将 21.5g 该物质溶解于 600mL 1mol·L-1 盐酸中,得到黄色溶液乙,将溶液乙分成两等份;
②将其中一份加热蒸干、灼烧,得到 8.0g 红棕色固体丙;
③向另一份溶液中加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥得到白色沉淀 57.4g。请回答:
(1)写出实验③中检出离子的结构示意图_____。
(2)样品甲中所含的三种元素为_____。
(3)写出实验①中反应的离子方程式_____。
(4)写出实验②中,检出固体丙中所含阳离子的实验方法_____。(写出实验操作、现象及结论)。
【答案】 Fe 、Cl、O FeClO+2H+=Fe3++Cl-+H2O 取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+
Fe 、Cl、O FeClO+2H+=Fe3++Cl-+H2O 取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+
【解析】
由实验②知,生成Fe2O3 8.0g,说明含Fe3+的物质的量为![]() ,
,
由实验③知,生成AgCl的质量为 57.4g,物质的量为![]() 。
。
从而得出21.5g 样品中,含Fe原子0.8mol-0.6mol=0.2mol、Cl原子0.2mol,
含O原子![]()
故甲的化学式为FeClO
(1)写出实验③中检出Cl-离子的结构示意图 。答案为
。答案为
(2)样品甲中所含的三种元素为Fe、Cl、O。答案为:Fe、Cl、O
(3)写出实验①中反应的离子方程式FeClO+2H+=Fe3++Cl-+H2O。
答案为:FeClO+2H+=Fe3++Cl-+H2O
(4)写出实验②中,检出固体丙中所含阳离子Fe3+的实验方法为:取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+。
答案为:取少量②中所得红棕色固体溶于足量盐酸,滴加 KSCN 溶液,若溶液变血红色,则含有 Fe3+


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
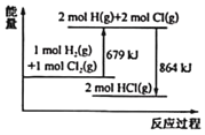
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
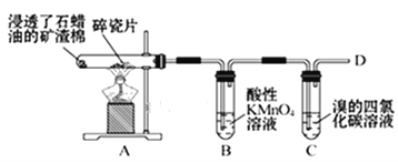
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应不能制得括号中纯净物的是( )
A.一定条件下,乙烯与氯气反应(1,2-二氯乙烷)
B.一定条件下,乙烯与水反应(乙醇)
C.光照条件下,等物质的量的氯气与乙烷反应(氯乙烷)
D.一定条件下,浓硝酸与苯反应(硝基苯)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO.下列叙述正确的是( )
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为﹣3
D.氮化铝晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃为无色晶体,结构分析证实:①分子中含有8个碳原子,②每个碳原子都以三条单键分别与三个碳原子相连,③碳碳键之间只有一种键角。则该分子式为:____________。它的结构简式为(写键线式)_____________。它的含苯环的同分异构体的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
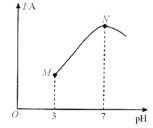
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com