
【题目】下列离子方程式中,正确的是
A.小苏打溶液与少量澄清石灰水混合:Ca2++OH-+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
B.AlCl3溶液中加入足量的氨水:Al3++4OH-=![]() +2H2O
+2H2O
C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D.钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为![]()
![]() 的三种酸
的三种酸![]() 、HB和
、HB和![]() 溶液,滴定的曲线如图所示。下列判断不正确的是
溶液,滴定的曲线如图所示。下列判断不正确的是![]()
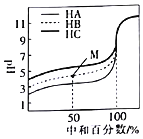
A.三种酸的电离平衡常数:![]()
B.滴定至M点时,溶液中:![]()
![]()
C.![]() 时,三种溶液中:
时,三种溶液中:![]()
![]()
D.当中和百分数达到![]() 时,三种溶液中:
时,三种溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)固体A的主要成分是________(写名称);
(2)铝土矿与过量烧碱反应的离子方程式为______、______;
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式__________;
(4)写出滤液D和过量CO2反应的离子方程式__________;
(5)指出流程乙的一个缺点是____________;
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粗氧化镍(主要含NO、CoO等)为原料制备纯镍,先用CO还原粗氧化镍制备羰化镍,羰化后的产物为Co2(CO)8、Ni(CO)4已知反应为:
①CO2(g)+C(s)2CO(g)△H
②Ni(s)+4CO(g)Ni(CO)4(g)△H<0.
Ni(CO)4的沸点43.2℃,熔点﹣19.3℃,分解温度135℃;Co2(CO)8沸点72℃,熔点31℃。下列有关叙述中不正确的是( )

A.①反应在900℃进行,温度升高,K增大,说明正反应△H>0
B.蒸馏提取Ni(CO)4应选择的适宜温度范围是43.2℃﹣72℃
C.蒸馏后采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳
D.提纯粗镍若简化为图装置,则温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:

则x=__________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。

①a、b两点的反应速率:v(a)______v(b)(填“>”、“<”、“=”)
②T1______T2 (填“>”、“<”、“=”),原因是_________________________。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平氧化还原反应方程式:
C2O42-+____MnO4-+____H+=____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
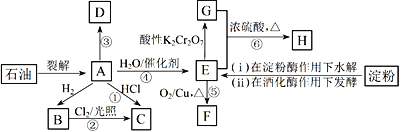
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com