
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
【答案】D
【解析】
A、根据表格中数据知,SO3在反应前2s的平均速率υ (SO3)=![]() =
=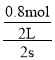 =0.2mol·L1·s1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,υ(O2)=
=0.2mol·L1·s1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,υ(O2)=![]() ×0.2 mol·L1·s1=0.1 mol·L1·s1,故A错误;
×0.2 mol·L1·s1=0.1 mol·L1·s1,故A错误;
B、化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;
C、相同温度下,起始时向容器中充入4molSO3,如果SO3完全转化为SO2和O2,SO2和O2的物质的量分别是4mol、2mol,为原来的2倍。现充入4molSO3,相当于增大压强,平衡正向移动,则SO2转化率增大,所以SO2转化率大于90%,相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率小于10%,故C错误;
D、温度不变,向该容器中再充入2molSO2、1molO2,可通过建模![]() 1容器为原平衡,将2molSO2、1molO2加入到2容器内,起始保持压强与1容器内一致,2容器内反应平衡与1完全等效,此时抽出中间隔板,将2压缩至1内,增大了压强,平衡正向移动,SO3的总物质的量增加,O2的总物质的量减小,所以比值增大,故D正确。
1容器为原平衡,将2molSO2、1molO2加入到2容器内,起始保持压强与1容器内一致,2容器内反应平衡与1完全等效,此时抽出中间隔板,将2压缩至1内,增大了压强,平衡正向移动,SO3的总物质的量增加,O2的总物质的量减小,所以比值增大,故D正确。


科目:高中化学 来源: 题型:
【题目】一定条件下,碳钢腐蚀与溶液pH的关系如下:
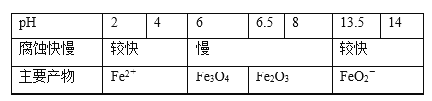
下列说法不正确的是( )
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行
B.除去NaCl中少量的![]() ,可将固体混合物制成热饱和溶液,冷却结晶、过滤
,可将固体混合物制成热饱和溶液,冷却结晶、过滤
C.将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率
D.将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴![]() 溶液,不久铁钉周围出现蓝色沉淀
溶液,不久铁钉周围出现蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极(填字母)。
(2)电池正极反应式为___________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.小苏打溶液与少量澄清石灰水混合:Ca2++OH-+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
B.AlCl3溶液中加入足量的氨水:Al3++4OH-=![]() +2H2O
+2H2O
C.将氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+
D.钠与水反应:2Na + 2H2O = 2Na++ 2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:(用序号填空)
① O2和O3 ; ②12C 与14C; ③ CH3 (CH2) 3 CH3和![]()
④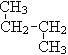 和
和![]() ;
;
(1)互为同位素的是_______ ;(2)互为同素异形体的是________;
(3)互为同分异构体的是________;(4)属于同一物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)2NH3(g)
①在反应体系中加入催化剂,反应速率______,该反应的反应热_______(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=_________,H2的转化率为______(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是________。
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)4NH3(g)+3O2(g) H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由乙苯生产苯乙烯的反应如下,有关说法正确的是
![]()
A. 该反应的类型为取代反应
B. 可用溴水鉴别乙苯和苯乙烯
C. 乙苯分子中所有原子可能在同一平面
D. 比乙苯多一个碳原子的同系物R的同分异构体(包含R)共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定pD=-lg{c(D+)},则该温度下,下列叙述正确的是
A.纯净的重水(D2O)中,pD=7
B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0
C.纯净的重水中,c(D+)=c(OD-)
D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com