
【题目】(1)配平氧化还原反应方程式:
C2O42-+____MnO4-+____H+=____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
【答案】21610280.005氧化剂不需要无色浅紫红色无影响偏小21%64%
【解析】
(1)根据得失电子守恒配平氧化剂、还原剂、氧化产物、还原产物的系数,根据电荷守恒计算H+系数,根据氢原子守恒计算水的系数;(2)①根据H++OH-===H2O计算中和的H+的总物质的量;②根据KMnO4溶液中Mn元素化合价由+7降低为+2分析;原溶液无色, KMnO4为紫红色;用少量蒸馏水将锥形瓶冲洗一下,溶质物质的量不变;达到滴定终点时俯视读数,消耗KMnO4溶液偏小;③根据H++OH-===H2O、得失电子守恒列式计算原试样中H2C2O4·2H2O、KHC2O4的质量分数。
(1)C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O![]() 前配5,MnO
前配5,MnO![]() 前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等,离子方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。 (2)①由H++OH-===H2O知,n(H+)=n(OH-)=0.25 mol·L-1×0.02 L=0.005 mol。②KMnO4溶液中Mn元素化合价由+7降低为+2,所以KMnO4溶液在滴定过程中作氧化剂;原溶液无色,而KMnO4为紫红色,所以不需要指示剂;当溶液中的H2C2O4和KHC2O4反应完全时,溶液由无色变为浅紫红色。若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,溶质物质的量不变,所以再继续滴定至终点,所测结果无影响;达到滴定终点时俯视读数,消耗KMnO4溶液偏小,则所得结果偏小;③由电子守恒得n(还)×2=0.10 mol·L-1×0.016 L×5,n(还)=0.004 mol。③设6.0 g 试样中H2C2O4·2H2O、KHC2O4的物质的量分别为n(H2C2O4·2H2O)、n(KHC2O4),由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05 mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04 mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01 mol,n(KHC2O4)=0.03 mol,H2C2O4·2H2O的质量分数为0.01mol×126g/mol÷6.0g×100%=21%,KHC2O4的质量分数为0.03mol×128g/mol÷6.0g ×100%=64%。
前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,再由电荷守恒在H+前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等,离子方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。 (2)①由H++OH-===H2O知,n(H+)=n(OH-)=0.25 mol·L-1×0.02 L=0.005 mol。②KMnO4溶液中Mn元素化合价由+7降低为+2,所以KMnO4溶液在滴定过程中作氧化剂;原溶液无色,而KMnO4为紫红色,所以不需要指示剂;当溶液中的H2C2O4和KHC2O4反应完全时,溶液由无色变为浅紫红色。若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,溶质物质的量不变,所以再继续滴定至终点,所测结果无影响;达到滴定终点时俯视读数,消耗KMnO4溶液偏小,则所得结果偏小;③由电子守恒得n(还)×2=0.10 mol·L-1×0.016 L×5,n(还)=0.004 mol。③设6.0 g 试样中H2C2O4·2H2O、KHC2O4的物质的量分别为n(H2C2O4·2H2O)、n(KHC2O4),由①得:2n(H2C2O4·2H2O)+n(KHC2O4)=0.05 mol,由②得:n(H2C2O4·2H2O)+n(KHC2O4)=0.04 mol,解上述两个方程式得:n(H2C2O4·2H2O)=0.01 mol,n(KHC2O4)=0.03 mol,H2C2O4·2H2O的质量分数为0.01mol×126g/mol÷6.0g×100%=21%,KHC2O4的质量分数为0.03mol×128g/mol÷6.0g ×100%=64%。


科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示,下列分析正确的是
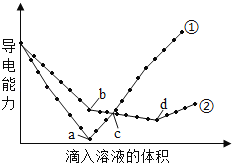
A. ②代表滴加H2SO4溶液的变化曲线
B. b点,两反应物物质的量之比为1: 2
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同物质的量浓度的OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16 g由O2和O3的混合气体中含有的分子数为0.5NA
B. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
C. 6.4 g CaC2晶体中所含的离子总数为0.3NA
D. 0.3 mol AgNO3受热完全分解(2AgNO3![]() 2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为0.25NA
2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 二氧化硅是将太阳能转化变为电能的常用材料
B. 玻璃、水晶、玛瑙的主要成分都是硅酸盐
C. 水玻璃可用于生产黏合剂和防火剂
D. 二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===![]() +2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
+2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
A. 还原性Cr3+>Fe2+>SO2
B. 氧化性Cr2O72->SO2>Fe3+
C. 两个反应中Fe2(SO4)3均作还原剂
D. Cr2O72-能将Na2SO3氧化成Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I(C12H14O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。
I可以用E和H在一定条件下合成:
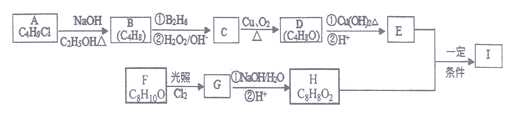
己知以下信息:①A的核磁共振氧谱表明其只有一种化学环境的氢;
②![]() ;
;
③化合物F苯环上的一氯代物只有两种且遇Fe3+不变色;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1) A的结构简式为____________,B所含官能团的名称是____________________。
(2)C的名称为______________,E的分子式为__________________。
(3) A→B、C→D的反应类型分别为____________________、______________________。
⑷写出F→G的化学方程式:____________________。
(5)I的结构简式为_____________________。
(6)I的同系物J比I相对分子质量小28,J的同分异构体中能同时满足如下条件:①苯环上只有一个取代基;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有_______种(不考虑立体异构)。上述同分异构体中有一种发生银镜反应并酸化后核磁共振氢谱为五组峰,且峰面积比为1:2:2:2:3,写出J的这种同分异构体的结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A. 新制氯水使红玫瑰变为白玫瑰,说明有Cl2
B. 加入石蕊溶液,溶液变红,说明该溶液一定不含HClO
C. 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D. 光照新制氯水有气泡逸出,该气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)B的轨道排布式是_____________________________________,A、B、C、D的第一电离能由小到大的顺序为___________________________________________。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________;
(3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com