
【题目】结合所学知识回答下列问题:
(1)配制FeCl3水溶液时,常加入少量_____溶液,结合离子方程式解释原因:______。
(2)工业冶炼镁的化学方程式:_____。由氯化镁溶液制备无水氯化镁的操作是_____。
(3)锅炉水垢中的CaSO4可先用Na2CO3溶液浸泡一段时间,放出浸泡液后,再用盐酸处理,用离子方程式表示过程中发生的化学反应:_______、_____。
【答案】盐酸 Fe3++3H2O![]() Fe(OH)3+3H+,加盐酸,增大氢离子浓度,抑制Fe3+水解,防止生成沉淀而导致溶液变浑浊。 MgCl2(熔融)
Fe(OH)3+3H+,加盐酸,增大氢离子浓度,抑制Fe3+水解,防止生成沉淀而导致溶液变浑浊。 MgCl2(熔融)![]() Mg+Cl2↑ 在氯化氢气流中加热 CaSO4+CO
Mg+Cl2↑ 在氯化氢气流中加热 CaSO4+CO![]() (aq)
(aq)![]() CaCO3+SO
CaCO3+SO![]() (aq) CaCO3+2H+=Ca2++H2O+CO2↑
(aq) CaCO3+2H+=Ca2++H2O+CO2↑
【解析】
(1)Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊。故答案为:盐酸;Fe3++3H2O
Fe(OH)3+3H+,配制溶液时,可加入盐酸抑制FeCl3水解,防止生成沉淀而导致溶液变浑浊。故答案为:盐酸;Fe3++3H2O![]() Fe(OH)3+3H+,加盐酸,增大氢离子浓度,抑制Fe3+水解,防止生成沉淀而导致溶液变浑浊。
Fe(OH)3+3H+,加盐酸,增大氢离子浓度,抑制Fe3+水解,防止生成沉淀而导致溶液变浑浊。
(2)工业冶炼镁是电解熔融状态的氯化镁生成镁和氯气,化学方程式:MgCl2(熔融)![]() Mg+Cl2↑。为抑制镁离子的水解,由氯化镁溶液制备无水氯化镁的操作是在氯化氢气流中加热。故答案为:MgCl2(熔融)
Mg+Cl2↑。为抑制镁离子的水解,由氯化镁溶液制备无水氯化镁的操作是在氯化氢气流中加热。故答案为:MgCl2(熔融)![]() Mg+Cl2↑;在氯化氢气流中加热;
Mg+Cl2↑;在氯化氢气流中加热;
(3)锅炉水垢中的CaSO4可先用Na2CO3溶液浸泡一段时间,CaCO3的溶解度小于CaSO4,沉淀由CaSO4转化为能溶于酸的CaCO3,放出浸泡液后,再用盐酸处理,用离子方程式表示过程中发生的化学反应:CaSO4+CO![]() (aq)
(aq) ![]() CaCO3+SO
CaCO3+SO![]() (aq),CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaSO4+CO
(aq),CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaSO4+CO![]() (aq)
(aq) ![]() CaCO3+SO
CaCO3+SO![]() (aq);CaCO3+2H+=Ca2++H2O+CO2↑。
(aq);CaCO3+2H+=Ca2++H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是![]()
A.反应![]() 室温下不能自发进行,则该反应的
室温下不能自发进行,则该反应的![]()
B.铅蓄电池放电过程中,正极质量增加,负极质量减小
C.![]() 下,在
下,在![]() 稀溶液中,加水,
稀溶液中,加水, 的值不变
的值不变
D.在NaHS溶液中,滴入少量![]() 溶液产生黑色沉淀,
溶液产生黑色沉淀,![]() 水解程度增大,pH增大
水解程度增大,pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在所给条件下可能大量共存的是( )
A.25℃,在pH=0的溶液中:Fe2+、Cu2+、Cl-、NO![]()
B.在FeCl3溶液中:Na+、OH-、SO![]() 、NO
、NO![]()
C.25℃,在水电离出的c(H+)=10-12molL-1的溶液中:NH![]() 、Cl-、HCO
、Cl-、HCO![]() 、NO
、NO![]()
D.能使酚酞显红色的溶液中:K+、Cl-、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为![]()
![]() 的三种酸
的三种酸![]() 、HB和
、HB和![]() 溶液,滴定的曲线如图所示。下列判断不正确的是
溶液,滴定的曲线如图所示。下列判断不正确的是![]()
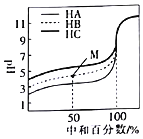
A.三种酸的电离平衡常数:![]()
B.滴定至M点时,溶液中:![]()
![]()
C.![]() 时,三种溶液中:
时,三种溶液中:![]()
![]()
D.当中和百分数达到![]() 时,三种溶液中:
时,三种溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00 mol·L-1NaOH溶液滴入20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示。

下列说法正确的是
A.室温时,HA的电离度约为10-6
B.图中B点时,溶液的Kw略大于1×10-14
C.图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-)
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)固体A的主要成分是________(写名称);
(2)铝土矿与过量烧碱反应的离子方程式为______、______;
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式__________;
(4)写出滤液D和过量CO2反应的离子方程式__________;
(5)指出流程乙的一个缺点是____________;
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粗氧化镍(主要含NO、CoO等)为原料制备纯镍,先用CO还原粗氧化镍制备羰化镍,羰化后的产物为Co2(CO)8、Ni(CO)4已知反应为:
①CO2(g)+C(s)2CO(g)△H
②Ni(s)+4CO(g)Ni(CO)4(g)△H<0.
Ni(CO)4的沸点43.2℃,熔点﹣19.3℃,分解温度135℃;Co2(CO)8沸点72℃,熔点31℃。下列有关叙述中不正确的是( )

A.①反应在900℃进行,温度升高,K增大,说明正反应△H>0
B.蒸馏提取Ni(CO)4应选择的适宜温度范围是43.2℃﹣72℃
C.蒸馏后采用230℃分解Ni(CO)4(g)制取金属镍,所获金属镍中常常含有碳
D.提纯粗镍若简化为图装置,则温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:

则x=__________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。

①a、b两点的反应速率:v(a)______v(b)(填“>”、“<”、“=”)
②T1______T2 (填“>”、“<”、“=”),原因是_________________________。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是
A. x=3 B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com