
| 10000g |
| 58g/mol |
| 10000 |
| 58 |
| ||
| 58 |


科目:高中化学 来源: 题型:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol?L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 实验①和②探究 |
| ② | 5 | 0.5 | |||
| ③ | 5 | 20 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在密闭容器中通入水蒸气 |
| B、升温 |
| C、保持体积不变,充入氦气使体系压强增大 |
| D、保持压强不变,充入氦气使容器体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
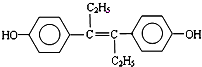
| A、M属于芳香族化合物 |
| B、M可与NaOH溶液或NaHCO3溶液发生反应 |
| C、1molM最多能与7molH2发生加成反应 |
| D、1molM与饱和溴水混合,最多消耗5molBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Ca2+、HCO3-、CI- |
| B、Na+、CO32-、Cl-、SO42- |
| C、K+、Fe2+、SO42-、Br- |
| D、Fe2+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,生成H2的质量与反应时间关系如图所示.下列叙述中不正确 的是( )
等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,生成H2的质量与反应时间关系如图所示.下列叙述中不正确 的是( )| A、失去的电子数:M>N |
| B、生成H2的反应速率:M>N |
| C、消耗HCl的物质的量:M>N |
| D、a、b两点时所消耗金属的质量:M>N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com