考点:铝的化学性质,镁的化学性质,有关混合物反应的计算
专题:计算题
分析:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H
2SO
4+2NaOH=Na
2SO
4+2H
2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,二者物质的量之和为0.35mol,溶液中溶质为Na
2SO
4,根据钠元素守恒可知此时n(Na
2SO
4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
倍.从200mL到240mL,NaOH溶解Al(OH)
3:NaOH+Al(OH)
3=NaAlO
2+2H
2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)
2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)
2为0.15mol,Al(OH)
3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,发生NaOH+Al(OH)
3=NaAlO
2+2H
2O,所以该阶段消耗n(NaOH)=n[Al(OH)
3]=0.2mol,氢氧化钠的浓度为
=5mol/L,以此来解答.
解答:
解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H
2SO
4+2NaOH=Na
2SO
4+2H
2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,二者物质的量之和为0.35mol,溶液中溶质为Na
2SO
4,根据钠元素守恒可知此时n(Na
2SO
4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
倍.从200mL到240mL,NaOH溶解Al(OH)
3:NaOH+Al(OH)
3=NaAlO
2+2H
2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)
2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)
2为0.15mol,Al(OH)
3为0.35mol-0.15mol=0.2mol,由于从200mL到240mL,发生NaOH+Al(OH)
3=NaAlO
2+2H
2O,所以该阶段消耗n(NaOH)=n[Al(OH)
3]=0.2mol,氢氧化钠的浓度为
=5mol/L,
A.由元素守恒可知n(Al)=n[Al(OH)
3]=0.2mol,n(Mg)=n[Mg(OH)
2]=0.15mol,所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,故A正确;
B.由电子守恒可知,生成的氢气为
=0.45mol,若在标况下,体积为0.45mol×22.4L/mol=10.08L,但状况未知,故B错误;
C.沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,溶液中溶质为Na
2SO
4,根据钠元素守恒可知此时n(Na
2SO
4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
倍,所以n(Na
2SO
4)=
×0.2L×5mol/L=0.5mol,所以硫酸的浓度为
=2.5mol/L,故C正确;
D.由上述分析可知,氢氧化钠溶液的物质的量浓度为5mol/L,故D正确;
故选B.
点评:本题考查镁铝的重要化合物及计算,为高频考点,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序及利用守恒计算,侧重分析与计算能力的考查,题目难度中等.

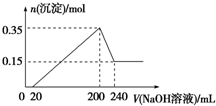 将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )

