

| A、装置①中烧杯内中加入黄色的K3[Fe(CN)6]溶液,一段时间后看不到Fe电极附近有蓝色沉淀生成,该装置可看作金属的析氢腐蚀 |
| B、装置②盐桥中的Cl-向硫酸铜溶液移动 |
| C、装置③中外电路电流方向:b极→a极 |
| D、装置④中阳极反应:2Cl--2e-═Cl2↑ |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| A、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移4NA个电子 |
| B、常温常压下,33.6L Cl2与56g Fe充分反应,转移电子数为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、在1L 0.2mol?L-1的硫酸铁溶液中含有的铁离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、金属的晶胞如图所示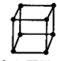 ,其配位数为8 ,其配位数为8 | ||||||||
| B、SO2分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为sp3杂化,是直线型分子 | ||||||||
| C、醋酸钠溶液中离子浓度的关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||||||||
D、已知反应2CH3OH(g)?CH3OCH3+H2O(g),某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量CH3OH,某时刻测得各组分浓度如下表,则此时正、逆反应速率的大小关系为:v正>v逆
|
查看答案和解析>>
科目:高中化学 来源: 题型:
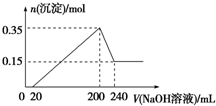 将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.则下列说法不正确的是( )| A、镁和铝的总质量为9g |
| B、合金与稀硫酸反应生成的氢气体积为10.08L |
| C、稀硫酸的物质的量浓度为2.5mol/L |
| D、氢氧化钠溶液的物质的量浓度为5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 18mol?L-1浓硫酸与足量铜反应,转移电子数为1.8NA |
| B、0.5L 0.2mol?L-1氯化铁溶液中Fe3+数目为0.1NA |
| C、0.4mol SiO2晶体中所含的共价键数目为1.6NA |
| D、已知t℃时,MgCO3的K=4.0×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定不是短周期元素 |
| B、可能属于过渡元素 |
| C、一定位于元素周期表的第14列上 |
| D、一定不是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH小于7 |
| B、存在关系式:c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、25℃时,由水电离产生的c(H+)>1×10-7mol?L-1 |
| D、向溶液中加入少量NaOH固体,c(S2-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com