
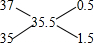 ,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,10吨纯度为90%的食盐中食盐的质量为10吨×90%=9吨,设23Na35Cl、23Na37Cl的质量分别为X、Y吨,则X+Y=9(质量守恒),
,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,10吨纯度为90%的食盐中食盐的质量为10吨×90%=9吨,设23Na35Cl、23Na37Cl的质量分别为X、Y吨,则X+Y=9(质量守恒),| X |
| 58 |
| Y |
| 60 |
| 3 |
| 1 |
| 37 |
| 60 |


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、铁易生锈,而铝在空气中较稳定,所以铁比铝活泼 |
| B、铝能在空气中稳定存在是因为其表面覆盖着一层保护膜 |
| C、氧化铝是一种难溶物质,是一种较好的耐火材料 |
| D、氢氧化铝能中和胃酸,可用于制胃药 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①中烧杯内中加入黄色的K3[Fe(CN)6]溶液,一段时间后看不到Fe电极附近有蓝色沉淀生成,该装置可看作金属的析氢腐蚀 |
| B、装置②盐桥中的Cl-向硫酸铜溶液移动 |
| C、装置③中外电路电流方向:b极→a极 |
| D、装置④中阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能使溴水和酸性KMnO4溶液褪色 |
| B、体积分数为75%的酒精溶液会使细菌蛋白质变性 |
| C、1mol甲烷和1mol氯气在光照条件下充分反应,生成1mol CH3Cl |
| D、CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ;现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3.请用物质的序号填写下列空白:
Ⅰ;现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3.请用物质的序号填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为
(1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com