
| |||||||||||||||
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:山东省青州一中2012届高三化学一轮跟踪训练:第6章第2讲电能转化为化学能——电解(鲁科版) 题型:058
电解原理在化学工业中有广泛的应用.
下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
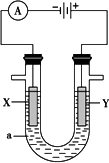
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为________,在X极附近观察到的现象是________.电解液中向X极方向移动的离子是________.
②Y电极上的电极反应式为________,检验该电极反应产物的方法是________.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应式为________.
②Y电极的材料是________,电极反应式为________.
③溶液中的c(Cu2+)与电解前相比________(填“变大”、“变小”或“不变”).
(3)如利用该装置实现铁上镀锌,电极X上发生的反应为________,电解池盛放的电镀液可以是________或________(只要求填两种电解质溶液).
查看答案和解析>>
科目:高中化学 来源:北京市海淀区2012届高三5月查漏补缺化学试题 题型:058
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表(表中不要留空格).

[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
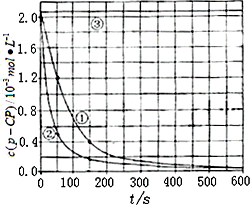
(2)请根据上图实验①曲线,计算降解反应在50~150 s内的反应速率:v(p-CP)=________mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:________.
(4)实验③得出的结论是:pH等于10时,________.
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:________.
查看答案和解析>>
科目:高中化学 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.
Ⅰ.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水成分搅拌、过滤.
(1)往滤渣中加入过量NaOH溶液,过滤.氢氧化铝与NaOH溶液反应的离子方程式是________.
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.观察到的现象是________.
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.依据实验过程回答下列问题:
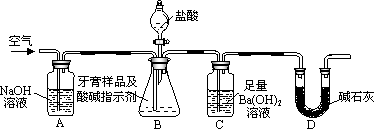
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有:________.
(4)C中反应生成BaCO3的化学方程式是________.
(5)下列各项措施中,不能提高测定准确度的是________(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________.
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是________.
查看答案和解析>>
科目:高中化学 来源:上海市黄浦区2013年高考一模化学试题 题型:058
某学生在0.1 mol/L NaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去.
该学生为了了解该过程的原因,进行了下列探究过程:
[实验探究]
实验1:加热0.1 mol/LNaHCO3溶液,测得溶液pH变化如下表
实验2:10℃时,在烧杯中加入0.1 mol/L NaHCO3溶液200 mL,测得该溶液pH=8.3,加热到100℃,测得pH=10.2,恢复到10℃,pH=9.8.
实验3:加热0.1 mol/L NaHCO3溶液,将产生的气体通入澄清石灰水,溶液变浑浊.
实验4:
①配制0.1 mol/L NaHCO3溶液和0.1 mol/L Na2CO3溶液各200 mL,10℃时,分别测得NaHCO3溶液pH=8.3,Na2CO3溶液pH=11.5.
②加热蒸发0.1 mol/L NaHCO3溶液200 mL,至溶液体积100 mL,停止加热,加水至200 mL,冷却至原温度,测得溶液pH=9.8.
③将0.1 mol/L NaHCO3溶液200 mL敞口放置三天,再加水至200 mL,测得溶液pH=10.1.
请根据上述实验回答下列问题:
1.用离子方程式表示0.1 mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)________、________.这两个平衡以________为主,理由是________.
2.实验3得到的结论是________.
3.结合实验2、3分析,加热0.1 mol/LNaHCO3溶液,pH增大的原因可能是________、________、________.
4.实验4①得到的结论是________.
5.实验4②“加水至200 mL”的目的是________.
实验4③可以得到的结论是________.
6.要确定NaHCO3溶液加热后pH增大的主要原因还需要解决的问题是________.
查看答案和解析>>
科目:高中化学 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:人民教育出版社 高一年级(必修)第一册 题型:
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:人民教育出版社 高三年级(选修)第三册 题型:
| |||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com