
下列常见现象与胶体无关的是
A.清晨在密林中看到一缕缕的光束
B.向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐
C.FeCl3溶液加入NaOH溶液产生红褐色沉淀
D.利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次月考化学试卷(解析版) 题型:填空题
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素。(共计12分)
Ⅰ.若在20L的密闭容器中按物质的量之比1︰2充入CO和H2,发生反应:
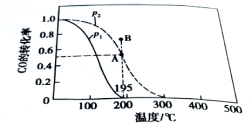
CO(g)+ 2H2(g) CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
(1)p2、195℃时,0~1min内,υ(H2)= mol/(L·min)。
(2)你认为p1 p2 ; p2、195℃时,B点,υ(正) υ(逆)。(填“﹤”“﹥”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为 ;
Ⅱ.NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
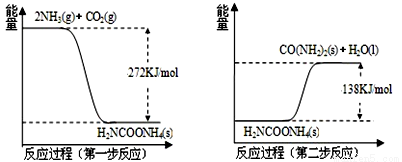
(1)NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 (填序号)
A.升高温度 B.加入催化剂
C.将尿素及时分离出去 D.增大反应体系的压强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一上10月月考化学试卷(解析版) 题型:选择题
实验室可用加热2KClO3分解的方法制取氧气,反应中使用MnO2作为催化剂,反应后从剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
A.溶解、过滤、蒸发、洗涤 B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤 D.溶解、洗涤、过滤、加热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高二上抽考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电池充电时其正极应与外电源的负极相连而成为阴极
B.氢氧燃料电池(碱性介质)的正极反应式:O2 +4e-→2O2-
C.粗铜精炼时,与电源正极相连的是纯铜
D.铁件上镀铜时,将铁件与电源的负极相连
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁育才学校高一上第一次阶段测化学试卷(解析版) 题型:选择题
下列关于纯净物、混合物、电解质、非电解质的正确组合为
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | 碳酸钠 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:填空题
(14分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g) CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g) CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O
D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
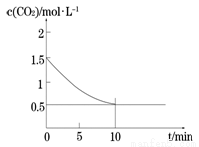
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时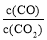 增大的是____________(填序号)。
增大的是____________(填序号)。
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则下列说法正确的是

A、电流方向:电极IV→ →电极I
→电极I
B、电极I发生还原反应
C、电极II逐渐溶解
D、电极III的电极反应:Cu2++2e-==Cu
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:实验题
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
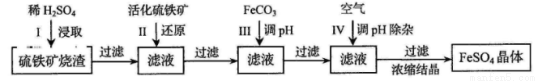
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s) 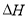 =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) 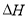 =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 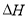 =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物一定具有的性质是
A.无色透明 B.有丁达尔效应
C.所得液体呈胶状 D.所得物质一定是悬浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com