
(14分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g) CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g) CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O
D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
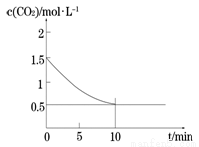
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时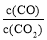 增大的是____________(填序号)。
增大的是____________(填序号)。
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2016届广东省等六校高三第一次联考化学试卷(解析版) 题型:填空题
(16分)
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
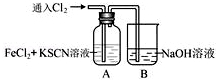
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为 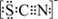 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN﹣被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式:_______ 。
(2)Cu2+可作为双氧水氧化CN﹣中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN﹣是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN﹣浓度可用离子色谱仪测定)
步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ | 现象与结论: 若____________________________ _______________________________ 若____________________________ ____________________ |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期中测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变
D.常温下,2NO(g)+2CO(g)=N2(g)+2CO2(g)能自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁育才学校高一上第一次阶段测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.不能发生丁达尔效应的分散系有氯化钠溶液、水等
B.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
C.黄河入海口处三角洲的形成与胶体性质有关
D.电泳现象说明胶体带电
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
下列常见现象与胶体无关的是
A.清晨在密林中看到一缕缕的光束
B.向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐
C.FeCl3溶液加入NaOH溶液产生红褐色沉淀
D.利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高二上10月月考化学试卷(解析版) 题型:填空题
(12分)I、 肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧的热化学方程式是_________________________
II、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和液态水,放出327.05kJ的热量。
(1)写出该反应的热化学方程式_______________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和水蒸气时,放出的热量是______________kJ。
(3)已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式__________________。
III、肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_________________________;
负极的电极反应式:_______________________ __。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
将Na、Mg、Al各0.3mol分别放入100mL、1mol/L的HCl中,同温同压下产生的气体的体积比是:
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
在下列各组离子中,能大量共存的且溶液呈无色是
A.Na+、H+ 、Al3+、CH3COO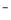 B.Mg2+、HCO3- 、Ca2+、NO3-
B.Mg2+、HCO3- 、Ca2+、NO3-
C.K+、MnO4-、Cl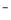 、Na+ D.NH4+、Cl
、Na+ D.NH4+、Cl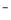 、 K+、OH-
、 K+、OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷(解析版) 题型:简答题
(8分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g) 2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com