
在下列各组离子中,能大量共存的且溶液呈无色是
A.Na+、H+ 、Al3+、CH3COO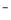 B.Mg2+、HCO3- 、Ca2+、NO3-
B.Mg2+、HCO3- 、Ca2+、NO3-
C.K+、MnO4-、Cl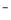 、Na+ D.NH4+、Cl
、Na+ D.NH4+、Cl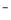 、 K+、OH-
、 K+、OH-
科目:高中化学 来源:2015-2016学年北大附中河南分校高二上9月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可放出热量,则该反应的△H<0
B.常温下浓硫酸与铝不反应,可用铝槽车运输
C.二氧化碳的电子式: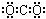
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁师大附属中学高二10月月考化学试卷(解析版) 题型:填空题
(14分)(1)反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;
FeO(s)+CO(g) △H1,平衡常数为K1;
反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+ H2(g) CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g)
CO(g)+ H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g)+ H2(g) CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
CO(g)+ H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g)+ H2(g) CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g)+ H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O
D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
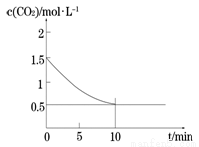
①该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为____________mol·L-1。
②下列措施中能使平衡时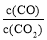 增大的是____________(填序号)。
增大的是____________(填序号)。
A.升高温度
B.增大压强
C.充入一定量的CO2
D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCI2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是
A.c(CO32-)=0.01mol•L-1,c(NH4+)>c(SO42-)
B.如果上述6种离子都存在,则c(Cl-)>c(SO42-)
C.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
D.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、k+
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:实验题
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
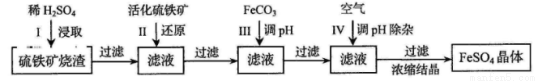
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s) 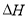 =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) 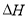 =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 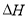 =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:填空题
(16分)将一定量的A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s) 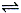 2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
2C(g)。忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 46.0 | a | b |
915 | c | 25.0 | d |
1000 | e | f | 15.0 |
回答下列问题:
(1)欲提高C的产率,应采取的措施为 ;
(2)该反应△H 0(填“<”或“>”);
(3)比较K(810℃) K(915℃) (填“<”、“>”或“=”),说明理由 ;
(4)915℃ 2.0MP时A的转化率为 ;
(5)比较b f(填“<”、“>”或“=”),说明理由 ;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K= (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g) 2C(g);ΔH<0,不能作为该反应达到化学平衡的标志的是
2C(g);ΔH<0,不能作为该反应达到化学平衡的标志的是
①v正(B)=v逆(C)②n(B)∶n(C)=1∶1 ③容器内压强不再改变 ④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变
A.②③④⑤ B.②③ C.①③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2016届山东省南校区高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列关于pH变化的判断正确的是
A.温度升高,Na2CO3溶液pH减小
B.氢氧化钠溶液久置于空气中,溶液pH变大
C.新制氯水经光照一段时间后,溶液pH减小
D.温度升高,纯水pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com