
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
分析 A、B、C、D为短周期元素,在常温、常压下,A单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料,则A为氢元素;工业上通过分离液态空气获得B的单质,其某种同素异形体是保护地球地表环境的重要屏障,则B为O元素;C是植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂,则C为N元素;室温下D单质为淡黄色粉末状固体,加热易熔化,该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S元素;E在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业,则E为Fe.
解答 解:A、B、C、D为短周期元素,在常温、常压下,A单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料,则A为氢元素;工业上通过分离液态空气获得B的单质,其某种同素异形体是保护地球地表环境的重要屏障,则B为O元素;C是植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂,则C为N元素;室温下D单质为淡黄色粉末状固体,加热易熔化,该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S元素;E在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业,则E为Fe.
(1)C与A形成的分子中原子数目为1:2的化合物为N2H4,C与B形成的分子中原子数目之比为1:2的无色气态化合物为N2O4,二者反应生成生成无毒物质和液态水,即生成氮气与水,16g N2H4的物质的量为$\frac{16g}{32g/mol}$=0.5mol,反应放出284kg的热量,则上述反应热化学反应方程式:2 N2H4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1136kJ/mol,
故答案为:2 N2H4(g)+N2O4(g)=3N2(g)+4H2O(l)△H=-1136kJ/mol;
(2)化合物X是元素D的氢化物,则X为H2S,X在水中的电离方程为H2S?H++HS-;元素E为Fe,在元素周期表中的位置是:第四周期第Ⅷ族,
故答案为:H2S?H++HS-;第四周期第Ⅷ族.
点评 本题以元素推断为载体,考查元素化合物知识、热化学方程式书写、电离方程式等,题目难度不大,注意掌握热化学方程式书写规则.


科目:高中化学 来源: 题型:解答题
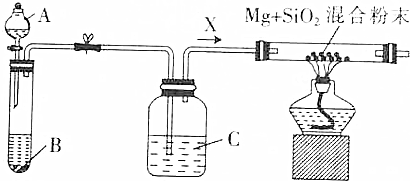
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
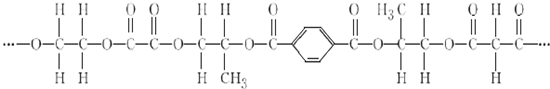
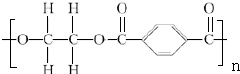 +2nH2O.
+2nH2O.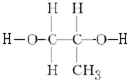 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加铁的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
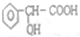
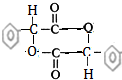 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com