
(12分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:

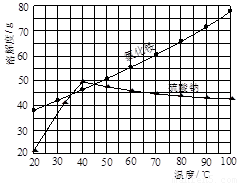
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有 、带铁圈的铁架台、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是 。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处 ;
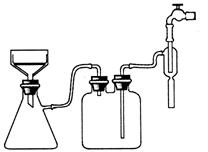
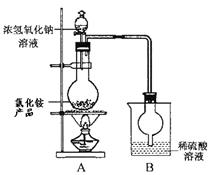
图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体 。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图2装置进行实验,充分反应后,测得B装置增重3.4g。则该粗产品中含氮的质量分数为 。
(1) (NH4)2SO4 +2NaCl ===2NH4Cl↓+ Na2SO4 (2) 蒸发皿
(3) 防止温度降低,氯化铵晶体析出而损失、 布氏漏斗的颈口斜面未与吸滤瓶的支管口相对
(4) AD (5) 25%
【解析】(1)根据反应物和生成物可知,方程式为(NH4)2SO4 +2NaCl ===2NH4Cl↓+ Na2SO4 。
(2)蒸发浓缩用到的主要仪器是蒸发皿。
(3)由于温度降低,会析出晶体,所以为防止温度降低氯化铵晶体析出而损失,需要趁热过滤。根据装置可判断,错误之处在于布氏漏斗的颈口斜面未与吸滤瓶的支管口相对。
(4)溶液浓度较高或溶质溶解度太小,都不利于得到较大的晶体,答案选AD。
(5)B装置增重3.4g,则生成氨气是3.4g,其物质的量是3.4g÷17g/mol=0.2mol,因此该粗产品中含氮的质量分数为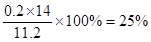 。
。


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

氯化铵和硫酸钠的溶解度随温度变化如下图所示。回答下列问题:

(1)欲制备10.7gNH4Cl,理论上需NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7 g NH4Cl,理论上需NaCl_______________g。
(2)实验室进行蒸发浓缩用到的主要仪器有_______________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_______________。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是_______________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com