
科目:高中化学 来源: 题型:实验题
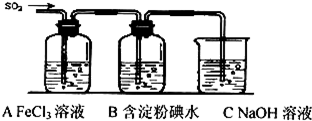
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电性 | B. | 水溶性 | C. | 氧化性 | D. | 化学稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
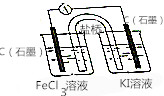 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )| A. | 左侧石墨为电池的正极,电极反应:Fe3++e-═Fe2+ | |
| B. | 右侧烧杯中发生还原反应,电极反应:2I--2e-═I2 | |
| C. | 右侧烧杯内溶液颜色变浅 | |
| D. | 盐桥中的K+流向右侧烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
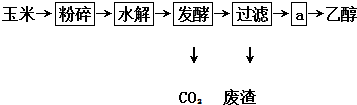
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
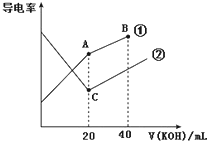
| A. | A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.1mol•L-1 | |
| B. | B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | C点水电离的c(OH-)大于A点水电离的c(OH-) | |
| D. | A、B、C三点溶液均有Kw=c(H+)•c(OH-)=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
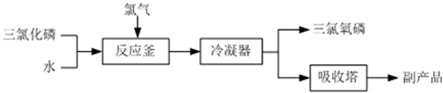
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

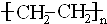 ;②C→D:CH3COOH+CH3CH2OH
;②C→D:CH3COOH+CH3CH2OH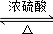 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com