
| A. | 可以用铝热反应制得单质镁 | |
| B. | 从海带中提取碘常用过氧化氢做还原剂 | |
| C. | 水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 | |
| D. | 铝热剂就是指铝和氧化铁混合物 |
分析 A.镁性质比铝活泼,用电解的方法冶炼;
B.过氧化氢具有强氧化性,可氧化碘离子;
C.含氮、磷的大量污水任意排放会导致水污染,使水体富营养化;
D.可以发生铝热反应的混合物称之为铝热剂.
解答 解:A.镁性质比铝活泼,用电解氯化镁的方法冶炼,铝只能用于冶炼活泼性比铝弱的金属,故A错误;
B.从海带中提取碘常用过氧化氢做氧化剂,可氧化碘离子生成碘,故B错误;
C.含氮、磷的大量污水任意排放会导致水污染,使水体富营养化,进而导致水华、赤潮,故C正确;
D.作为铝热剂重要组成的金属氧化物,铝热剂应为Al和过渡元素的氧化物所形成的混合物,故D错误;
故选C.
点评 本题考查海水资源综合利用及铝热反应,为高频考点,侧重考查元素化合物性质,熟悉海水中提取碘的方法及流程,知道金属冶炼方法与金属活动性强弱关系,题目难度不大.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 酯化反应 | D. | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.77×10-4 | 4.9×10-16 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOOH+CN-═HCOO-+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 果糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
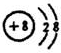 .
.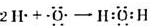 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
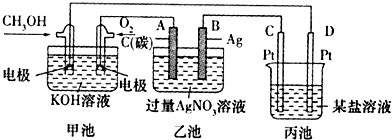
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com