
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。
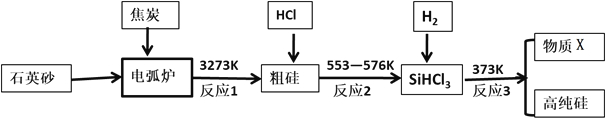
(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
【答案】 第三周期第IVA族 1:2 蒸馏或分馏 HCl SiCl4+3H2O=H2SiO3↓+4HCl或3SiCl4+4H2O=H3SiO4↓+4HCl 3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2O 0.80或80.00%
【解析】(1)硅是14号元素,在周期表中位于第三周期第IVA族,反应1为二氧化硅和碳的反应:SiO2+3C![]() SiC+2CO,反应中氧化剂是二氧化硅和C,还原剂是C,氧化剂和还原剂的物质的量之比为1:2,故答案为:第三周期第IVA族;1:2;
SiC+2CO,反应中氧化剂是二氧化硅和C,还原剂是C,氧化剂和还原剂的物质的量之比为1:2,故答案为:第三周期第IVA族;1:2;
(2)SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃),由于沸点差别较大,可以通过分馏除去杂质;氯化氢与粗硅反应生成SiHCl3,SiHCl3与氢气又反应生成硅和氯化氢,氯化氢可以循环利用,故答案为:分馏;HCl;
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,SiCl4遇水剧烈反应的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl,故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,说明生成了一氧化氮,反应的化学方程式为3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2O,故答案为:3Si+4HNO3+18HF =3H2SiF6+4NO↑+8H2O;
(5)100吨纯度为75%的石英砂中含有二氧化硅的质量为75t,其中含有硅元素75t×![]() =35t,经第一步反应制得的粗硅中含硅28吨,该过程中硅的产率=
=35t,经第一步反应制得的粗硅中含硅28吨,该过程中硅的产率=![]() ×100%=80.00%,故答案为:80.00%。
×100%=80.00%,故答案为:80.00%。


科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
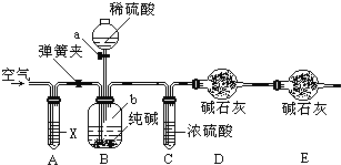
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为85.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为87.6g.试回答:
(1)鼓入空气的目的是___________,装置A中试剂X应选用___________;
(2)若没有C装置,则会导致测定结果___________(填“偏大”或“偏小”);
(3)装置B中发生反应的离子方程式______________________________;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 g
D. AlN中氮的化合价为+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn==ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl==2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)用双线桥法表示下述反应的电子转移MnO2 + 4HCl(浓)![]() MnCl2 +Cl2↑+ 2H2O________
MnCl2 +Cl2↑+ 2H2O________
(3)在反应 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为________。
(4)若反应 3Cu + 8HNO3(稀)==3Cu(NO3)2 + 2NO↑+ 4H2O中转移了3mol电子,则生成的NO气体在标况下的体积是_____________L。
(5)配平下面两个反应① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl,____________
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系数是1的也请填上),_____
根据以上两个反应反应,写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平。______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验氯化氢气体中是否混有氯气,可采用的方法是( )
A.用干燥的蓝色石蕊试纸B.用干燥有色布条
C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合第ⅦA族元素性质特征的是( )
A.易形成-1价离子B.从上到下原子半径逐渐减小
C.最高价氧化物的水化物显酸性D.从上到下氢化物的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用流程如下:
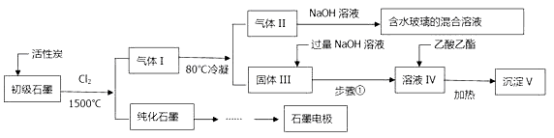
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)已知1mol石墨完全转化为金刚石需要吸收1.9kJ的能量。请写出石墨转化为金刚石的热化学反应方程式:
(2)向反应器中通入Cl2前,需通一段时间的N2。高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。80℃冷凝的目的是: 由活性炭得到气体Ⅱ的化学反应方程式为:
(3)加入过量NaOH溶液得到溶液IV的离子反应方程式为:
(4)用化学反应原理解释得到沉淀V的过程中乙酸乙酯和加热的作用: 。1kg初级石墨最多可获得V的质量为 kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com