
【题目】检验氯化氢气体中是否混有氯气,可采用的方法是( )
A.用干燥的蓝色石蕊试纸B.用干燥有色布条
C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】
三位分别来自瑞士、美国、英国的科学家因发展“冷冻电子显微镜技术对溶液中的生物分子进行高分辨率结构测定”所做出的贡献而获得2017年诺贝尔化学奖。含有有机杂化锌、锗以及砷等金属的硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为_________。位于元素周期表五个分区中的________区。
(2)元素锗与砷中,第一电离能较大的是________ (填元素符号,下同),基态原子核外未成对电子数较少的是________。
(3)元素砷与氮同主族,二者的氢化物中熔沸点较高的是_________,原因是________。
(4)H2SeO3分子中Se 原子的杂化形式为________,H2SeO4的酸性比H2SeO3强,原因是________ 。
(5)气态SeO3分子的立体构型为______,与SeO3互为等电子体的一种离子为_____(填离子符号)。
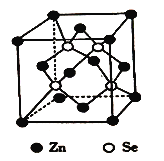
(6)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_____,若该晶胞密度为ρg/cm3,硒化锌的摩尔质量为Mg/mol。用NA代表阿伏伽德罗常数的数值,则晶胞参数α为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L的FeCl3与0.2L 1mol/L的KCl溶液中,Cl-的物质的量浓度之比为 ( )
A. 5:2 B. 1:1 C. 3:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I用CO2和氢气制备甲醇是解决能源危机的方向之一。
已知:2H2(g)+CO(g) CH3OH(g) △H1= -90.7kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -23.5 kJ/mol
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H3= -246.4 kJ/mol
(1)则CO2与氢气合成甲醇的热化学方程式为:____________________________________________,T℃时,将4molCO2与10mol H2通入1L密闭容器中,时间t与甲醇物质的量的关系见下表
时间t/h | 0 | 2 | 4 | 6 | 8 | 10 |
n(甲醇)/mol | 0 | 1.4 | 2.3 | 2.8 | 3.0 | 3.0 |
回答下列问题:
(2)欲提高氢气的平衡转化率,应采取的措施为____________________________(任意写两种)
(3)该温度下,反应的平衡常数K=________
II 采用如下装置电解亚硫酸钠亦可制备硫酸与氯碱工业的一种产物
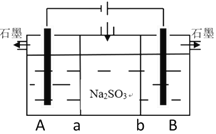
(4)A、B池中的电解质溶液应该是_____________、_____________,a为______离子交换膜。
(5)写出B池发生的电极反应式___________________________________________________
(6)Na2SO3溶液中离子浓度由大到小的排列顺序为__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。
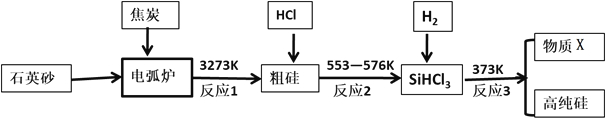
(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,分别进行下列两项实验:
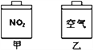
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
已知:N2O4(g)![]() 2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化反应与还原反应在同一元素中进行的是( )
A. Cl2+2NaOH=NaCl+NaClO+H2O
B. Fe+CuSO4=FeSO4+Cu
C. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com