
【题目】I用CO2和氢气制备甲醇是解决能源危机的方向之一。
已知:2H2(g)+CO(g) CH3OH(g) △H1= -90.7kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -23.5 kJ/mol
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H3= -246.4 kJ/mol
(1)则CO2与氢气合成甲醇的热化学方程式为:____________________________________________,T℃时,将4molCO2与10mol H2通入1L密闭容器中,时间t与甲醇物质的量的关系见下表
时间t/h | 0 | 2 | 4 | 6 | 8 | 10 |
n(甲醇)/mol | 0 | 1.4 | 2.3 | 2.8 | 3.0 | 3.0 |
回答下列问题:
(2)欲提高氢气的平衡转化率,应采取的措施为____________________________(任意写两种)
(3)该温度下,反应的平衡常数K=________
II 采用如下装置电解亚硫酸钠亦可制备硫酸与氯碱工业的一种产物
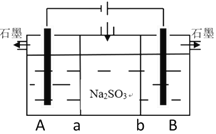
(4)A、B池中的电解质溶液应该是_____________、_____________,a为______离子交换膜。
(5)写出B池发生的电极反应式___________________________________________________
(6)Na2SO3溶液中离子浓度由大到小的排列顺序为__________________________________
【答案】 CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.2kJ/mol 降低温度、增大压强、增加CO2浓度、及时移出产物(任意写两种) 9 NaOH溶液 稀硫酸 阳 H2O-2e-+SO32-=2H++SO42- c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【解析】(1)①2H2(g)+CO(g) CH3OH(g)△H1= -90.7kJ/mol,②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2= -23.5 kJ/mol,③3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H3= -246.4 kJ/mol,根据盖斯定律,将①×3+②-③得:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=(-90.7kJ/mol)×3+(-23.5 kJ/mol)-(-246.4 kJ/mol)=-49.2kJ/mol,故答案为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.2kJ/mol;
(2)欲提高氢气的平衡转化率,需要使平衡正向移动,可以采取的措施有降低温度、增大压强、增加CO2浓度、及时移出产物等,故答案为:降低温度、增大压强、增加CO2浓度、及时移出产物;
(3) CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始(mol) 4 10 0 0
反应(mol)3.0 9.0 3.0 3.0
平衡(mol)1.0 1.0 3.0 3.0
该温度下,反应的平衡常数K=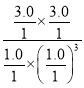 =9,故答案为:9;
=9,故答案为:9;
(4)根据实验目的:电解亚硫酸钠亦可制备硫酸与氯碱工业的一种产物,氯碱工业的产物有氢氧化钠、氢气和氯气。根据图示,需要将亚硫酸根离子氧化生成硫酸根离子,因此B产生硫酸,应该加入稀硫酸,则亚硫酸根离子向B移动,则钠离子向A移动,A极上溶液中的氢离子放电生成氢气,A产生氢氧化钠,因此A中加入稀氢氧化钠溶液;根据上述分析,a为阳离子交换膜,b为阴离子交换膜,故答案为:NaOH溶液;稀硫酸;阳;
(5)B池发生的电极反应式为H2O-2e-+SO32-=2H++SO42-,故答案为:H2O-2e-+SO32-=2H++SO42-;
(6)Na2SO3溶液水解显碱性,溶液中离子浓度由大到小的排列顺序为c(Na+)>c (SO32-)>c (OH-)>c (HSO3-)> c (H+),故答案为:c(Na+)>c (SO32-)>c (OH-)>c (HSO3-)> c (H+)。


科目:高中化学 来源: 题型:
【题目】下列鉴别物质的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和A1C13溶液
B. 用澄淸石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用CaCl2溶液鉴别Na2CO3溶液和NaHCO3溶液
D. 用淀粉溶液鉴别加碘盐和未加碘盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A. 用蒸馏的方法制取蒸馏水
B. 用过滤的方法除去NaCl溶液中含有的少量KCl
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为________。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L的稀盐酸。
①该学生用量筒量取________mL上述浓盐酸进行配制;
②所需的实验仪器有:
①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有________。
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是________(填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填选项字母)
a.![]() b.
b.![]() c.
c. ![]() d.
d. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验氯化氢气体中是否混有氯气,可采用的方法是( )
A.用干燥的蓝色石蕊试纸B.用干燥有色布条
C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可用来衡量一个国家的石油化工发展水平。下列关于乙烯说法正确的是
A. 与乙烷互为同分异构体 B. 分子中存在碳碳叄键
C. 能使酸性高锰酸钾溶液褪色 D. 分子中存在碳氧双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. NH3 + HCl =NH4Cl
B. 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
C. H2SO4+2NaOH = Na2SO4+2H2O
D. Cl2 + H2O = HCl + HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com