
【题目】下列反应属于氧化还原反应的是
A. NH3 + HCl =NH4Cl
B. 2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
C. H2SO4+2NaOH = Na2SO4+2H2O
D. Cl2 + H2O = HCl + HClO
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】I用CO2和氢气制备甲醇是解决能源危机的方向之一。
已知:2H2(g)+CO(g) CH3OH(g) △H1= -90.7kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -23.5 kJ/mol
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H3= -246.4 kJ/mol
(1)则CO2与氢气合成甲醇的热化学方程式为:____________________________________________,T℃时,将4molCO2与10mol H2通入1L密闭容器中,时间t与甲醇物质的量的关系见下表
时间t/h | 0 | 2 | 4 | 6 | 8 | 10 |
n(甲醇)/mol | 0 | 1.4 | 2.3 | 2.8 | 3.0 | 3.0 |
回答下列问题:
(2)欲提高氢气的平衡转化率,应采取的措施为____________________________(任意写两种)
(3)该温度下,反应的平衡常数K=________
II 采用如下装置电解亚硫酸钠亦可制备硫酸与氯碱工业的一种产物
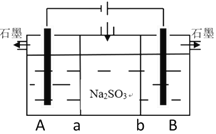
(4)A、B池中的电解质溶液应该是_____________、_____________,a为______离子交换膜。
(5)写出B池发生的电极反应式___________________________________________________
(6)Na2SO3溶液中离子浓度由大到小的排列顺序为__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化反应与还原反应在同一元素中进行的是( )
A. Cl2+2NaOH=NaCl+NaClO+H2O
B. Fe+CuSO4=FeSO4+Cu
C. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___________。
(2)写出天然橡胶单体(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
A.②④①③ B. ④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H
③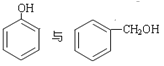 ④
④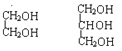
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦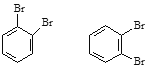
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题。

(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)配制时,其正确的操作顺序(是![]() 用字母表示)__________________。
用字母表示)__________________。
A.用30mL水洗涤烧杯和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(3)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”,“偏小”,“无影响”)。
a. 量筒量取浓盐酸时俯视观察凹液面______。
b.最后经振荡、摇匀、静置时,发现液面下降,再加适量的蒸馏水______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验需要450 mL 0.10 mol·L-1 Na2CO3溶液,某同学选用Na2CO3·10H2O晶体进行配制,简要回答下列问题:
(1)该实验应选择__________mL容量瓶。
(2)需称取Na2CO3·10H2O的质量为__________g。
(3)该实验的正确操作顺序是_______________(填字母代号)。
A.用托盘天平称取Na2CO3·10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)另需配制一定浓度的NaOH溶液,称量时若将NaOH固体置于滤纸上称量,则所配溶液浓度______;若容量瓶中有检漏时残留的少量蒸馏水,会使所配溶液浓度______;NaOH溶解后未经______;立即注入容量瓶至刻度线,会使浓度______;定容时必须使凹液面最低处与刻度线相切,若仰视会使所配溶液浓度______(凡涉及浓度变化填“偏高”、“偏低”或“无影响”)。
(5)向200 mL所配的 0.10 mol·L-1Na2CO3溶液中逐滴加入10 mL 12.25%稀H2SO4(ρ=1.0 g/cm3),理论上能收集到标准状况下的气体__________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com