
【题目】下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为________。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L的稀盐酸。
①该学生用量筒量取________mL上述浓盐酸进行配制;
②所需的实验仪器有:
①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有________。
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是________(填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填选项字母)
a.![]() b.
b.![]() c.
c. ![]() d.
d. ![]()
【答案】12mol/L 14.6 250ml容量瓶 A、D、E c
【解析】
(1)盐酸溶液的物质的量浓度c=![]() =12mol/L;
=12mol/L;
(2)①设所需的浓盐酸的体积为VmL,根据溶液稀释定律c浓·V浓=c稀·V稀可知:12mol/L×VmL=0.7mol/L×250mL,解得V=14.6;
②根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还缺少250mL容量瓶;
③A、用量筒量取浓盐酸时俯视凹液面,则浓盐酸的体积偏小,配制出的溶液的浓度偏小,故A选;
B、未恢复到室温就将溶液注入容量瓶并进行定容,则冷却后溶液体积偏小,浓度偏高,故B不选;
C、容量瓶用蒸馏水洗后未干燥,对所配溶液的浓度无影响,故C不选;
D、定容时仰视液面,则溶液体积偏大,浓度偏小,故D选;
E、未洗涤烧杯和玻璃棒,造成溶质的损失,则浓度偏小,故E选。
答案选ADE;
(3)HCl的物质的量为![]() ,HCl的质量为
,HCl的质量为![]() ×36.5g/mol=
×36.5g/mol=![]() ,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(
,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(![]() +1000)g,溶液的体积为
+1000)g,溶液的体积为![]() ,故所得溶液的物质的量浓度为
,故所得溶液的物质的量浓度为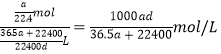 ,答案选c。
,答案选c。


科目:高中化学 来源: 题型:
【题目】资料显示联苯双酯能增强肝脏解毒功能,减轻肝脏的病理损伤,促进肝细胞再生并保护肝细胞,从而改善肝功能。合成联苯双酯的工艺路线如下:
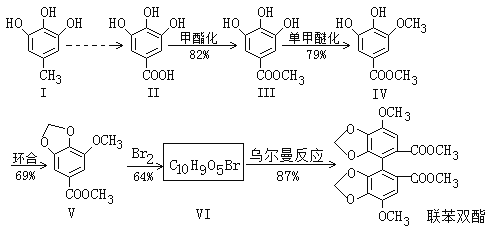
已知:![]()
回答下列问题:
(1)化合物Ⅲ中的官能团名称为______________,该化合物的核磁共振氢谱中有_____组峰。
(2)Ⅴ→Ⅵ的反应类型为______________。写出一定条件下Ⅴ→Ⅵ的化学方程式:____________________。
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:_________________
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:_________________,该合成路线为何要经过多步而不是一步完成,目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)画出Fe3+的外围电子排布图:___________;SCN-的结构式为________,SCN-中σ键与π键数目之比为________。
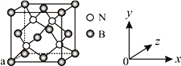
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如右图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是___________。
![]()
(3)N与B可形成化合物立方氮化硼,其结构与金刚石相似,是超硬材料,立方氮化硼属于________晶体。已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
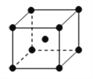
(4)单质铁的晶体结构如右图所示,该堆积方式名称为________。已知该晶胞的密度为ρg/cm3,则铁原子半径的计算式为_________ pm。
(5)磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)是两种重要试剂。磺酰氯可看成是硫酸分子中2个羟基被氯原子取代后的衍生物,主要用于有机合成;亚硫酰氯可与水剧烈反应,常用于与一些易水解的无机氯化物(MgCl2·6H2O)作用制取无水金属氯化物(MgCl2)。
已知:SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) ……(Ⅰ)
2SOCl2(g) ……(Ⅰ)
SO2(g)+Cl2(g)![]() SO2Cl2(g) ………………(Ⅱ)
SO2Cl2(g) ………………(Ⅱ)
回答下列问题:
(a)SO2Cl2的空间构型为_______________。
(b)反应Ⅰ、Ⅱ的化学平衡常数分别为K1、K2,则:SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)的平衡常数K=_______。
2SOCl2(g)的平衡常数K=_______。
(c)在50L恒容密闭容器中充入1.0molSO2和1.0molCl2发生反应Ⅱ,测得SO2的转化率随时间变化关系如右图所示。
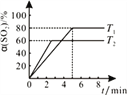
①反应Ⅱ属于________反应(填“放热”“ 吸热”)。在T1温度下,从反应开始至刚好达到平衡时的平均反应速率v(SO2)=___________。为了提高SO2的平衡转化率,除改变温度外,还可以采取的一条措施是__________。
②在T2温度下反应,起始压强为101kPa,则平衡时气体的压强p平=__________kPa。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),T2温度下,该反应的化学平衡常数Kp=______________。
(d)无水AlCl3在有机合成中应用广泛。蒸干AlCl3溶液不能得到无水AlCl3,用化学方程式表示其原因:______________。工业上常用SOCl2与AlCl3·6H2O混合并加热制备无水AlCl3,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L的FeCl3与0.2L 1mol/L的KCl溶液中,Cl-的物质的量浓度之比为 ( )
A. 5:2 B. 1:1 C. 3:1 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )

A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I用CO2和氢气制备甲醇是解决能源危机的方向之一。
已知:2H2(g)+CO(g) CH3OH(g) △H1= -90.7kJ/mol
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -23.5 kJ/mol
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H3= -246.4 kJ/mol
(1)则CO2与氢气合成甲醇的热化学方程式为:____________________________________________,T℃时,将4molCO2与10mol H2通入1L密闭容器中,时间t与甲醇物质的量的关系见下表
时间t/h | 0 | 2 | 4 | 6 | 8 | 10 |
n(甲醇)/mol | 0 | 1.4 | 2.3 | 2.8 | 3.0 | 3.0 |
回答下列问题:
(2)欲提高氢气的平衡转化率,应采取的措施为____________________________(任意写两种)
(3)该温度下,反应的平衡常数K=________
II 采用如下装置电解亚硫酸钠亦可制备硫酸与氯碱工业的一种产物
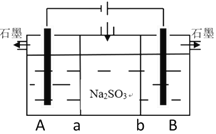
(4)A、B池中的电解质溶液应该是_____________、_____________,a为______离子交换膜。
(5)写出B池发生的电极反应式___________________________________________________
(6)Na2SO3溶液中离子浓度由大到小的排列顺序为__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,分别进行下列两项实验:
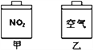
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
已知:N2O4(g)![]() 2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
2NO2(g) △H>0在以上两情况下,甲和乙容器的体积大小,正确的是
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___________。
(2)写出天然橡胶单体(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3
A.②④①③ B. ④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H
③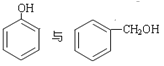 ④
④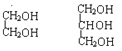
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦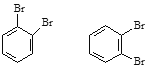
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com