
【题目】资料显示联苯双酯能增强肝脏解毒功能,减轻肝脏的病理损伤,促进肝细胞再生并保护肝细胞,从而改善肝功能。合成联苯双酯的工艺路线如下:
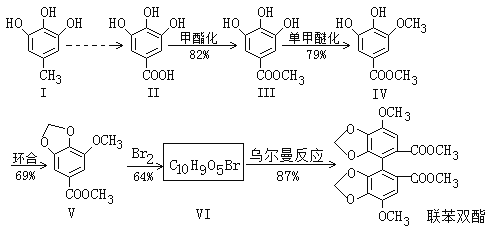
已知:![]()
回答下列问题:
(1)化合物Ⅲ中的官能团名称为______________,该化合物的核磁共振氢谱中有_____组峰。
(2)Ⅴ→Ⅵ的反应类型为______________。写出一定条件下Ⅴ→Ⅵ的化学方程式:____________________。
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:_________________
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
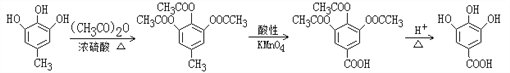
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:_________________,该合成路线为何要经过多步而不是一步完成,目的是__________________。
【答案】 羟基、酯基 4 取代反应 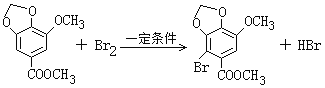
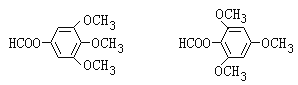
 保护酚羟基不被氧化
保护酚羟基不被氧化
【解析】(1). 由化合物III的结构简式可知,化合物III中含有的官能团是羟基和酯基,故答案为:羟基、酯基;
(2). 由化合物V的结构简式可知,化合物V的分子式为C10H10O5,化合物VI的分子式为C10H9O5Br,说明化合物V与Br2发生取代反应生成化合物VI,由化合物VI发生乌尔曼反应生成联苯双酯,根据联苯双酯的结构简式可知,化合物VI的结构简式为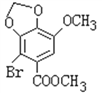 ,所以一定条件下Ⅴ→Ⅵ的化学方程式为:
,所以一定条件下Ⅴ→Ⅵ的化学方程式为: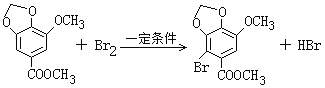 ,故答案为:取代反应;
,故答案为:取代反应; ;
;
(3). 比Ⅴ多2个H原子,说明该有机物的分子式为:C10H12O5,能发生银镜反应,又能发生水解反应,且水解产物之一能与FeCl3溶液发生显色反应,说明该有机物中含有甲酸和酚构成的酯基,苯环上的一氯代物只有1种,说明该有机物为一种对称结构,再结合分子式可知,应含有甲醇和酚形成的醚键,符合条件的结构简式有: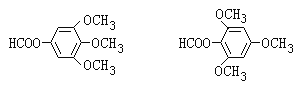 ,故答案为:
,故答案为: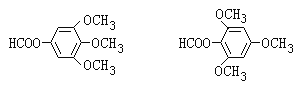 ;
;
(4). 由化合物I合成化合物II,根据I和II的结构简式可知,需将I中的甲基氧化生成羧基,因酚羟基具有还原性,所以在氧化甲基时需先将酚羟基保护起来,再将甲基氧化,由所给信息可知,合成时可先用(CH3CO)2O与化合物I反应生成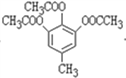 ,
, 被酸性高锰酸钾溶液氧化生成
被酸性高锰酸钾溶液氧化生成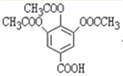 ,
, 在酸性条件下水解生成化合物II,所以合成路线为:
在酸性条件下水解生成化合物II,所以合成路线为: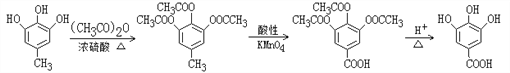 ,故答案为:
,故答案为: ;保护酚羟基不被氧化。
;保护酚羟基不被氧化。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),得电子能力最强的原子是______,失电子能力最强的单质与水反应的化学方程式是___________________,常温下单质为液态的非金属单质是____________。
(2)元素④的离子结构示意图为__________________。
(3)⑥⑦⑧气态氢化物的化学式分别为________、________、________,其中以
(4)写出③的单质置换出⑥的单质的化学方程式:__________________。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________。
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其主要成分的化学式不相对应的是
A. 明矾一KA1(SO4)2·12H2O B. 铝热剂一A1 C. 纯碱一Na2CO3 D. 石英—SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、甲醇既是重要的化工原料,又可作为燃料,利用CO和H2在催化剂作用下可合成甲醇(g)。
(1)已知相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
合成甲醇(g)的热化学方程式为______________________________________________。
(2)500K、101KPa条件下,反应过程中测得n(CO)、n(H2)、n(CH3OH)随时间t变化的关系如图甲所示。现保持其它条件不变,起始只改变温度,在改变的这个温度下反应至t1时刻,此时n(H2)比图象中的值大,那么该温度可能是________。
A、700K B、373K C、以上均不对
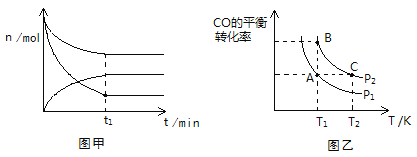
(3)在一容积可变的密闭容器中充入1 mol CO和2 mol H2,发生反应并达到平衡,CO的平衡转化率随温度(T)和压强(P)的变化曲线如图乙所示。P1、P2的大小关系为________;A、B、C三点的平衡常数(K)大小关系为______________________。
Ⅱ、可逆反应:①X(g)+2Y(g)![]() 2Z(g);②2M(g)
2Z(g);②2M(g)![]() N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间放有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
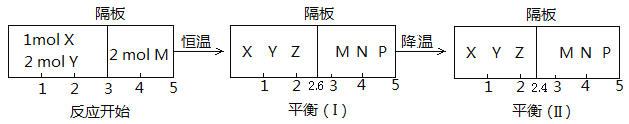
(4)反应①的正反应ΔH______0(填“>”或“<”)。
(5)反应开始时体系的压强与达平衡(Ⅰ)时体系的压强之比为_________(用分数表示)。
(6)在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数(Ⅰ)______(Ⅱ)。
A、大于 B、小于 C、等于 D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl﹣离子浓度最大的是( )
A.0.5molL﹣1HCl溶液
B.1molL﹣1MgCl2溶液
C.2molL﹣1NaCl溶液
D.1molL﹣1FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别物质的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和A1C13溶液
B. 用澄淸石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用CaCl2溶液鉴别Na2CO3溶液和NaHCO3溶液
D. 用淀粉溶液鉴别加碘盐和未加碘盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是
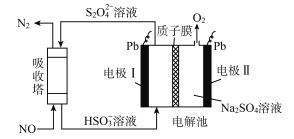
A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D. 每处理1 mol NO电解池质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为________。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L的稀盐酸。
①该学生用量筒量取________mL上述浓盐酸进行配制;
②所需的实验仪器有:
①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有________。
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是________(填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填选项字母)
a.![]() b.
b.![]() c.
c. ![]() d.
d. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com