
【题目】下列溶液中,Cl﹣离子浓度最大的是( )
A.0.5molL﹣1HCl溶液
B.1molL﹣1MgCl2溶液
C.2molL﹣1NaCl溶液
D.1molL﹣1FeCl3溶液
科目:高中化学 来源: 题型:
【题目】I. 填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_________。
(2)元素周期表中位于第8纵行的铁元素属于_________族。
(3)元素周期表中最活泼的非金属元素位于第_________纵行。
(4)所含元素超过18种的周期是第_________周期。
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
(1)元素x在周期表中的位置是第________周期、第________族。
(2)四种元素最高价氧化物的水化物中,酸性最强的是_____,碱性最强的是_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)碳的一种同位素原子核内有8个中子,则该原子的符号为________,其质量数为______。
(2)用电子式表示CaCl2的形成过程______________________________和H2S的形成过程______________________________。
(3)A-、B2-、C+、D2+四种离子的电子数均为10。其原子半径由大到小的顺序为____________(填元素符号),其离子半径由大到小的顺序为____________(填离子符号)
(4)10g D2O的物质的量为_______,它与_______gCH4所含电子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示联苯双酯能增强肝脏解毒功能,减轻肝脏的病理损伤,促进肝细胞再生并保护肝细胞,从而改善肝功能。合成联苯双酯的工艺路线如下:
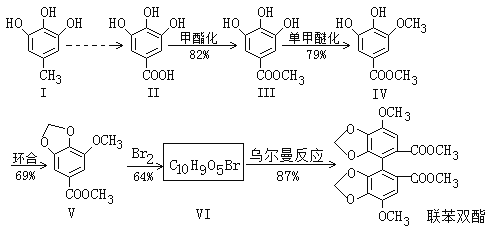
已知:![]()
回答下列问题:
(1)化合物Ⅲ中的官能团名称为______________,该化合物的核磁共振氢谱中有_____组峰。
(2)Ⅴ→Ⅵ的反应类型为______________。写出一定条件下Ⅴ→Ⅵ的化学方程式:____________________。
(3)写出比Ⅴ多2个H原子,且符合下列条件的任意两种同分异构体的结构简式:_________________
①苯环上的一氯代物只有1种;
②能发生银镜反应;
③水解产物之一能与FeCl3溶液发生显色反应;
(4)根据题目中的相关信息并结合已学知识,写出Ⅰ→Ⅱ的合成路线:_________________,该合成路线为何要经过多步而不是一步完成,目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室保存下列物质的方法中,不正确的是( )
A.少量金属钠保存在煤油里
B.浓硫酸存放在广口试剂瓶中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.氯水应装在棕色细口瓶中密封避光保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国研制出“可充电钠——二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时每消耗3mo1C02,转移12mol电子
C. 充电时碳纳米管接直流电源的正极
D. 充电时阳极反应为C+2Na2CO3-4e-=4Na++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,一定能大量共存的是
A. 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42-
B. 含有NaClO的溶液中:K+,Al3+,Br-,S2-
C. 澄清透明溶液:Cu2+,SO42-,HCO3-,H+
D. 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )

A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com