
【题目】按要求回答下列问题。
(1)碳的一种同位素原子核内有8个中子,则该原子的符号为________,其质量数为______。
(2)用电子式表示CaCl2的形成过程______________________________和H2S的形成过程______________________________。
(3)A-、B2-、C+、D2+四种离子的电子数均为10。其原子半径由大到小的顺序为____________(填元素符号),其离子半径由大到小的顺序为____________(填离子符号)
(4)10g D2O的物质的量为_______,它与_______gCH4所含电子数相同。
【答案】![]() 14
14 ![]()
![]() Na>Mg>O>F O2-> F->Na+>Mg2+ 0.5mol 8g
Na>Mg>O>F O2-> F->Na+>Mg2+ 0.5mol 8g
【解析】
(1)碳的质子数为6,原子核内有8个中子,质量数=质子数+中子数=14,该原子的符号为![]() 。答案为:
。答案为:![]() 、14
、14
(2)CaCl2的形成过程用电子式表示为:![]() ,H2S的形成过程用电子式表示为:
,H2S的形成过程用电子式表示为:![]() 。答案为:
。答案为: ![]() 、
、![]()
(3)A-、B2-、C+、D2+四种离子的电子数均为10,说明A、B、C、D分别为:F、O、Na、Mg元素。电子层数越多原子半径越大,电子层数相同时核电荷数越大原子半径越小,所以原子半径由大到小的顺序为:Na>Mg>O>F,电子层数相同时核电荷数越大离子半径越小,A-、B2-、C+、D2+四种离子的电子层数相同,所以其离子半径由大到小的顺序为:O2-> F-> Na+> Mg2+。答案为:Na>Mg>O>F、O2-> F-> Na+> Mg2+
(4)D2O的摩尔质量为20g/mol,10g D2O的物质的量为![]() =0.5mol,1个 D2O 分子所含电子的个数为10,0.5mol D2O 分子所含电子的物质的量=0.5mol
=0.5mol,1个 D2O 分子所含电子的个数为10,0.5mol D2O 分子所含电子的物质的量=0.5mol![]() =5mol,1个 CH4分子含电子的个数为10,所以需要CH4的质量为:
=5mol,1个 CH4分子含电子的个数为10,所以需要CH4的质量为:![]() 16=8g.
16=8g.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】某金属A及其化合物之间有如下的转化关系:
(1)写出A、B的化学式:A_______,B_________。
(2)写出B→D的化学方程式_______________________________。
(3)写出B→C的离子方程式________________________________。
(4)写出E→C的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语作答
(1)书写电子式:H2____________N2_________CH4_________NaOH_________
(2)用电子式表示物质的形成过程
MgCl2_______________________________________
H2O_______________________________________
(3)两种含10电子的粒子反应生成两种10电子的粒子的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列四个反应:
①2Na+2H2O===2NaOH+H2↑
②2F2+2H2O===4HF+O2
③Cl2+H2O===HCl+HClO
④C+H2O(g) ![]() CO+H2
CO+H2
试从氧化还原的角度,回答下列问题:
(1)水只作氧化剂的是________;
(2)水只作还原剂的是________;
(3)水既不作氧化剂又不作还原剂的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离常数如下右表。下列说法正确的是
酸 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-6 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
A. H2CO3的电离方程式为H2CO3![]() 2H++CO
2H++CO![]()
B. 酸性强弱顺序为H2SO3>H2CO3>HSO>HCO
C. 0.2 mol/L Na2CO3溶液中离子浓度大小顺序为:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)>c(H+)
)>c(HCO)>c(OH-)>c(H+)
D. 足量SO2气体通入NaHCO3溶液中,反应的离子方程式为SO2+HCO==HSO+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)![]() 2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,X的物质的量减小
B.增大压强(缩小容器体积),Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其主要成分的化学式不相对应的是
A. 明矾一KA1(SO4)2·12H2O B. 铝热剂一A1 C. 纯碱一Na2CO3 D. 石英—SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,Cl﹣离子浓度最大的是( )
A.0.5molL﹣1HCl溶液
B.1molL﹣1MgCl2溶液
C.2molL﹣1NaCl溶液
D.1molL﹣1FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丁烷可用作稀有元素萃取剂。实验室制取1-溴丁烷的原理如下:
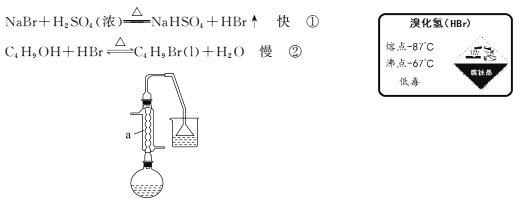
【产品制备】
如图,在125 mL烧瓶中加入10 mL水,然后加入12 mL(0.22 mol)浓硫酸,摇匀冷却至室温,再加入7.5 mL(0. 08 mol)正丁醇,混合后加入10.3 g(0. 10 mol)溴化钠晶体,充分振荡,加入几粒沸石,在石棉网上用小火加热烧瓶并回流半小时。
(1)仪器a的名称为____,用恰当的化学原理解释能发生反应①的原因是____。
(2)烧杯中所用试剂为水,其主要目的是吸收 ___(填化学式);
(3)制备过程中烧瓶中溶液逐渐出现浅黄色,为此,有人提出用浓H3PO4代替浓H2SO4,其理由是____。
【初步提纯】
已知:醇类可与浓硫酸作用生成![]() 盐溶于浓硫酸中(
盐溶于浓硫酸中(![]() 盐难溶于有机溶剂)。
盐难溶于有机溶剂)。
![]()
步骤①:加热蒸馏出烧瓶中所有的溴丁烷粗品。
步骤②:将粗品用5mL浓硫酸洗涤。
步骤③:将步骤②中有机层依次分别用水、饱和碳酸氢钠溶液和水各10 mL洗涤。
步骤④:将步骤③有机物移入蒸馏烧瓶中,加热蒸馏,得到产品6. 85 g。
(4)步骤①的目的是分离出产品中的无机物,判断溴丁烷是否完全蒸馏出来的方法是:用一支试管收集几滴馏出液,向其中加入少许水并摇动,如果____表明溴丁烷已经被 完全蒸馏出来。
(5)步骤②用5mL浓硫酸洗涤的目的是除去___ ;第一次水洗可以除去大部分硫酸,第二次水洗的目的是____。
(6)实验的产率为____(M(C4H9Br) =137 g/mol);制备过程中,有利于提高产品产率的措施有适当延长回流时间及____(选填字母)。
A.回流时适时搅拌溶液 B.将块状NaBr研细使用
C.将正丁醇分次加入 D.对正丁醇进行干燥处理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com