
【题目】1-溴丁烷可用作稀有元素萃取剂。实验室制取1-溴丁烷的原理如下:
【产品制备】
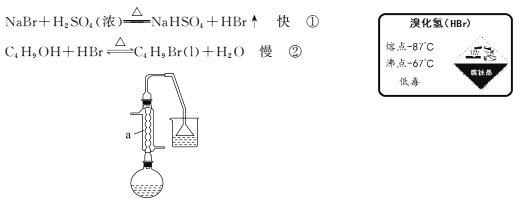
如图,在125 mL烧瓶中加入10 mL水,然后加入12 mL(0.22 mol)浓硫酸,摇匀冷却至室温,再加入7.5 mL(0. 08 mol)正丁醇,混合后加入10.3 g(0. 10 mol)溴化钠晶体,充分振荡,加入几粒沸石,在石棉网上用小火加热烧瓶并回流半小时。
(1)仪器a的名称为____,用恰当的化学原理解释能发生反应①的原因是____。
(2)烧杯中所用试剂为水,其主要目的是吸收 ___(填化学式);
(3)制备过程中烧瓶中溶液逐渐出现浅黄色,为此,有人提出用浓H3PO4代替浓H2SO4,其理由是____。
【初步提纯】
已知:醇类可与浓硫酸作用生成![]() 盐溶于浓硫酸中(
盐溶于浓硫酸中(![]() 盐难溶于有机溶剂)。
盐难溶于有机溶剂)。
![]()
步骤①:加热蒸馏出烧瓶中所有的溴丁烷粗品。
步骤②:将粗品用5mL浓硫酸洗涤。
步骤③:将步骤②中有机层依次分别用水、饱和碳酸氢钠溶液和水各10 mL洗涤。
步骤④:将步骤③有机物移入蒸馏烧瓶中,加热蒸馏,得到产品6. 85 g。
(4)步骤①的目的是分离出产品中的无机物,判断溴丁烷是否完全蒸馏出来的方法是:用一支试管收集几滴馏出液,向其中加入少许水并摇动,如果____表明溴丁烷已经被 完全蒸馏出来。
(5)步骤②用5mL浓硫酸洗涤的目的是除去___ ;第一次水洗可以除去大部分硫酸,第二次水洗的目的是____。
(6)实验的产率为____(M(C4H9Br) =137 g/mol);制备过程中,有利于提高产品产率的措施有适当延长回流时间及____(选填字母)。
A.回流时适时搅拌溶液 B.将块状NaBr研细使用
C.将正丁醇分次加入 D.对正丁醇进行干燥处理
【答案】 球形冷凝管 浓硫酸为高沸点酸,氢溴酸为低沸点酸,加热蒸发出HBr,反应①正向移动从而正向进行。(或高沸点酸制低沸点酸)。 HBr 浓H2SO4有较强的氧化性,-1价的溴被氧化成溴单质,而浓磷酸是非氧化性酸,不能氧化溴离子 溶液中没有分层现象 除去正丁醇 除去NaHCO3(NaHCO3和Na2SO4) 62.5% AB
【解析】(1)a用于冷凝,仪器a的名称为球形冷凝管,①溴化钠与浓硫酸反应制HBr,用恰当的化学原理解释能发生反应①的原因是浓硫酸为高沸点酸,氢溴酸为低沸点酸,加热蒸发出HBr,反应①正向移动从而正向进行。(或高沸点酸制低沸点酸)。(2)烧杯中所用试剂为水,其主要目的是吸收 HBr;(3)制备过程中烧瓶中溶液逐渐出现浅黄色,为此,有人提出用浓H3PO4代替浓H2SO4,其理由是浓H2SO4有较强的氧化性,-1价的溴被氧化成溴单质,而浓磷酸是非氧化性酸,不能氧化溴离子;(4)用一支试管收集几滴馏出液,向其中加入少许水并摇动,溶液中没有分层现象,表明溴丁烷已经被完全蒸馏出来;(5)步骤②用5mL浓硫酸洗涤的目的是除去正丁醇 ;第一次水洗可以除去大部分硫酸,第二次水洗的目的是除去NaHCO3(NaHCO3和Na2SO4);(6)实验的产率=![]() ;制备过程中,有利于提高产品产率的措施:A.回流时适时搅拌溶液,使反应充分进行,故A正确;B.将块状NaBr研细使用,增大接触面积,使反应充分进行,故B正确;C.将正丁醇分次加入,总量不变,不能增大产率;故C错误; D.对正丁醇进行干燥处理,反应中有水,故D错误;故选AB。
;制备过程中,有利于提高产品产率的措施:A.回流时适时搅拌溶液,使反应充分进行,故A正确;B.将块状NaBr研细使用,增大接触面积,使反应充分进行,故B正确;C.将正丁醇分次加入,总量不变,不能增大产率;故C错误; D.对正丁醇进行干燥处理,反应中有水,故D错误;故选AB。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)碳的一种同位素原子核内有8个中子,则该原子的符号为________,其质量数为______。
(2)用电子式表示CaCl2的形成过程______________________________和H2S的形成过程______________________________。
(3)A-、B2-、C+、D2+四种离子的电子数均为10。其原子半径由大到小的顺序为____________(填元素符号),其离子半径由大到小的顺序为____________(填离子符号)
(4)10g D2O的物质的量为_______,它与_______gCH4所含电子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国研制出“可充电钠——二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时每消耗3mo1C02,转移12mol电子
C. 充电时碳纳米管接直流电源的正极
D. 充电时阳极反应为C+2Na2CO3-4e-=4Na++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中,一定能大量共存的是
A. 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42-
B. 含有NaClO的溶液中:K+,Al3+,Br-,S2-
C. 澄清透明溶液:Cu2+,SO42-,HCO3-,H+
D. 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)画出Fe3+的外围电子排布图:___________;SCN-的结构式为________,SCN-中σ键与π键数目之比为________。
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如右图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是___________。
![]()
(3)N与B可形成化合物立方氮化硼,其结构与金刚石相似,是超硬材料,立方氮化硼属于________晶体。已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
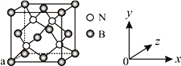
(4)单质铁的晶体结构如右图所示,该堆积方式名称为________。已知该晶胞的密度为ρg/cm3,则铁原子半径的计算式为_________ pm。
(5)磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)是两种重要试剂。磺酰氯可看成是硫酸分子中2个羟基被氯原子取代后的衍生物,主要用于有机合成;亚硫酰氯可与水剧烈反应,常用于与一些易水解的无机氯化物(MgCl2·6H2O)作用制取无水金属氯化物(MgCl2)。
已知:SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) ……(Ⅰ)
2SOCl2(g) ……(Ⅰ)
SO2(g)+Cl2(g)![]() SO2Cl2(g) ………………(Ⅱ)
SO2Cl2(g) ………………(Ⅱ)
回答下列问题:
(a)SO2Cl2的空间构型为_______________。
(b)反应Ⅰ、Ⅱ的化学平衡常数分别为K1、K2,则:SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)的平衡常数K=_______。
2SOCl2(g)的平衡常数K=_______。
(c)在50L恒容密闭容器中充入1.0molSO2和1.0molCl2发生反应Ⅱ,测得SO2的转化率随时间变化关系如右图所示。
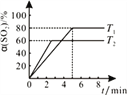
①反应Ⅱ属于________反应(填“放热”“ 吸热”)。在T1温度下,从反应开始至刚好达到平衡时的平均反应速率v(SO2)=___________。为了提高SO2的平衡转化率,除改变温度外,还可以采取的一条措施是__________。
②在T2温度下反应,起始压强为101kPa,则平衡时气体的压强p平=__________kPa。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),T2温度下,该反应的化学平衡常数Kp=______________。
(d)无水AlCl3在有机合成中应用广泛。蒸干AlCl3溶液不能得到无水AlCl3,用化学方程式表示其原因:______________。工业上常用SOCl2与AlCl3·6H2O混合并加热制备无水AlCl3,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )

A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As的化合物在研究和生产中有许多重要用途。
(1)基态As原子的核外电子排布式为_________。
(2)N的第一电离能比O大,原因是______________。
(3)NH4+中H-N-H的键角比NH3中H-N-H 的键角_______(填“大”或“小”),原因是____________。
(4)K3AsO4中含有的化学键类型包括________;AsO43- 的空间构型为______。As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。
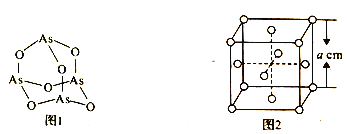
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5 是_______晶体。
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2 (小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数的数值为NA,则该晶胞中含有P 原子的个数为______,该晶体的密度为_________(用含NA、a 的代数式表示) g.cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com