
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
【答案】Al N2 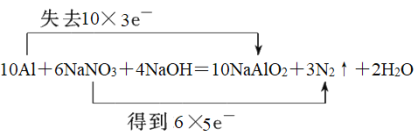 10 8 10 2 8 1 5
10 8 10 2 8 1 5
【解析】
(1)反应10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O中Al元素化合价升高,被氧化,在反应中失去电子,被氧化的元素为Al;氮元素化合价降低,硝酸钠是氧化剂,因此还原产物是N2;
(2)反应中铝失去电子数为10×3e-,NaNO3得到电子数为6×5e-,所以用“双线桥法”标明反应中电子转移的方向和数目为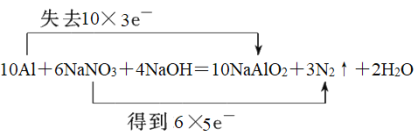 ;
;
(3)氮元素化合价从+5价降低到0价,即得到1mol氮气转移10mol电子,因此反应中每生成标况下22.4L N2即1mol,转移10mol电子。
(4)反应中铁元素化合价从+2价升高到+3价,失去1个电子。氮元素化合价从+5价降低到+1价,得到4个电子,根据电子得失守恒以及原子守恒、电荷守恒可知配平后的方程式为8Fe2++10H++2NO3=8Fe3++N2O↑+5H2O


科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)![]() 2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,X的物质的量减小
B.增大压强(缩小容器体积),Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++ 2NH3·H2O![]() Ag(NH3)2+ 2H2O。下列分析不正确的是
Ag(NH3)2+ 2H2O。下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:AgCl (s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B. 实验可以证明NH3结合Ag+能力比Cl-强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
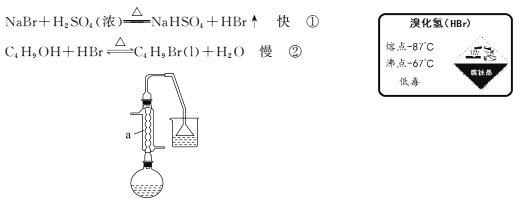
【题目】1-溴丁烷可用作稀有元素萃取剂。实验室制取1-溴丁烷的原理如下:
【产品制备】
如图,在125 mL烧瓶中加入10 mL水,然后加入12 mL(0.22 mol)浓硫酸,摇匀冷却至室温,再加入7.5 mL(0. 08 mol)正丁醇,混合后加入10.3 g(0. 10 mol)溴化钠晶体,充分振荡,加入几粒沸石,在石棉网上用小火加热烧瓶并回流半小时。
(1)仪器a的名称为____,用恰当的化学原理解释能发生反应①的原因是____。
(2)烧杯中所用试剂为水,其主要目的是吸收 ___(填化学式);
(3)制备过程中烧瓶中溶液逐渐出现浅黄色,为此,有人提出用浓H3PO4代替浓H2SO4,其理由是____。
【初步提纯】
已知:醇类可与浓硫酸作用生成![]() 盐溶于浓硫酸中(
盐溶于浓硫酸中(![]() 盐难溶于有机溶剂)。
盐难溶于有机溶剂)。
![]()
步骤①:加热蒸馏出烧瓶中所有的溴丁烷粗品。
步骤②:将粗品用5mL浓硫酸洗涤。
步骤③:将步骤②中有机层依次分别用水、饱和碳酸氢钠溶液和水各10 mL洗涤。
步骤④:将步骤③有机物移入蒸馏烧瓶中,加热蒸馏,得到产品6. 85 g。
(4)步骤①的目的是分离出产品中的无机物,判断溴丁烷是否完全蒸馏出来的方法是:用一支试管收集几滴馏出液,向其中加入少许水并摇动,如果____表明溴丁烷已经被 完全蒸馏出来。
(5)步骤②用5mL浓硫酸洗涤的目的是除去___ ;第一次水洗可以除去大部分硫酸,第二次水洗的目的是____。
(6)实验的产率为____(M(C4H9Br) =137 g/mol);制备过程中,有利于提高产品产率的措施有适当延长回流时间及____(选填字母)。
A.回流时适时搅拌溶液 B.将块状NaBr研细使用
C.将正丁醇分次加入 D.对正丁醇进行干燥处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成神经抑制剂F的一种路线如图所示:
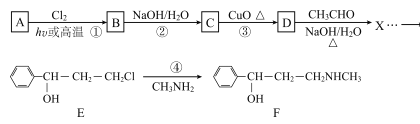
已知:![]()
请回答下列问题:
(1)已知芳香烃A的相对分子质量为92,A的结构简式为____;B的系统命名是___ ;C中含氧官能团的名称是____。
(2)反应③的化学反应方程式为____;①~④中属于取代反应的是____。
(3)D分子中最多有____个原子共平面。
(4)④的反应中,因反应温度控制不当,常常有副产物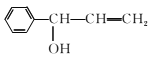 生成,写出可能的副反应方程式____。
生成,写出可能的副反应方程式____。
(5)包含C在内,C的同分异构体中芳香族化合物共有____种,其中满足下列条件同分异构体的结构简式为____。
①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备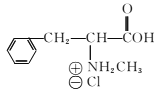 的合成路线(无机试剂自选):________________________________________
的合成路线(无机试剂自选):________________________________________
流程示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
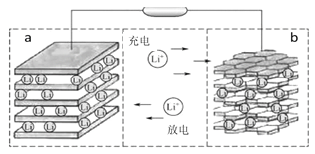
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是
A. 体积大小: ④>③>②>① B. 原子数目: ③>①>④>②
C. 密度大小: ④>②>③>① D. 质量大小: ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.聚甲基丙烯酸甲酯(PMMA)俗称有机玻璃。其结构简式为: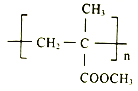 。以下是有机玻璃的一种合成路线:
。以下是有机玻璃的一种合成路线:
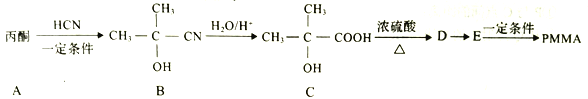
回答下列问题:
(1)A的结构简式为________,A生成B的反应类型是______反应。
(2)C中官能团的名称是________ ,D的名称是________(系统命名法)。
(3)由E生成PMMA的化学方程式为____________。
II.由合成PMMA得到的启示,可应用于由苯酚为主要原料制备![]()
(4)![]() 的同分异构体中符合下列条件的有_____种(不考虑立体异构):
的同分异构体中符合下列条件的有_____种(不考虑立体异构):
①属于![]() 的二取代物
的二取代物
②取代基处于对位且完全相同
③能够与NaHCO3溶液反应产生CO2
其中核磁共振氢谱有5个峰,峰面积之比为6:2:1:1的是_________(填结构简式)。
(5)参照I中有机玻璃的合成路线,设计并完善![]() 的合成路线:
的合成路线:
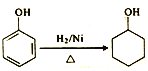 ____________
____________![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com