
| A. | BaCl2、NaNO3、NH4Cl | B. | K2CO3、HCl、CaCl2 | ||
| C. | Na2CO3、HNO3、HCl | D. | K2CO3、KCl、H2SO4 |
分析 常温下,等物质的量混合,溶液pH大于7,则溶液显碱性,
A.等物质的量的BaCl2、NaNO3、NH4Cl三种物质混合无反应发生;
B.等物质的量K2CO3、HCl、CaCl2混合,三种物质之间发生反应生成碳酸氢钾;
C.等物质的量的Na2CO3、HNO3、HCl混合,发生:CO32-+2H+=CO2↑+H2O;
D.等物质的量的K2CO3、KCl、H2SO4混合,存在:n(H+)=2n(CO32-),发生:CO32-+2H+=H2O+CO2↑,
根据混合后溶液生成物的性质进行判断溶液的酸碱性.
解答 解:A.等物质的量的BaCl2、NaNO3、NH4Cl三种物质混合无反应发生,铵根离子水解溶液显酸性,溶液PH<7,故A错误;
B.等物质的量K2CO3、HCl、CaCl2混合,三种物质之间发生反应生成碳酸氢钾K2CO3+HCl=KHCO3+KCl,碳酸氢根离子水解溶液显碱性,PH>7,故B正确;
C.等物质的量的Na2CO3、HNO3、HCl混合,发生:CO32-+2H+=CO2↑+H2O,溶液呈中性,若考虑二氧化碳溶解溶液PH<7,故C错误;
D.等物质的量的K2CO3、KCl、H2SO4混合,存在:n(H+)=2n(CO32-),发生:CO32-+2H+=H2O+CO2↑,反应的溶液PH=7,如考虑CO2的溶解,则PH<7,故D错误.
故选B.
点评 本题考查溶液混合后pH的判断,题目难度中等,注意把握题中各物质混合后生成物的性质,考虑盐类的水解.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中每生成1mol N2O,消耗67.2LCO | |
| B. | 等质量的N2O和CO2含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | 上述反应中若有3 mol的CO被还原,则转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二项 | B. | 三项 | C. | 五项 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
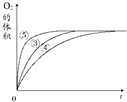 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
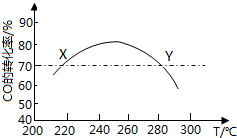 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H<0 | |
| C. | 反应温度应控制在260℃~280℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com