
【题目】下列关于苯酚的叙述中,不正确的是
A. 其浓溶液如果不慎沾在皮肤上,应立即用酒精擦洗
B. 其水溶液显强酸性,俗称石炭酸
C. 超过65℃可以与水以任意比互溶
D. 纯净的苯酚是无色晶体,在空气中易被氧化而呈粉红色
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 麦芽糖和蔗糖的水解产物相同B. 天然油脂属于酯类物质
C. 淀粉和纤维素的分子式不同D. 石油裂化和裂解都可制得烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:(A)NaOH+HCl===NaCl+H2O (B)2FeCl3+Cu===2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)______,(B)________;
(2)如果(A或B)不能,说明其原因_________________________________________;
(3)如果(A或B)可以,则在下面方框中画出装置图并写出正、负极材料及电极反应式
________
负极:________、_______________________________________;
正极:________、________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,C是短周期中原子半径最大的。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是___________。C2B2所含的化学键类型有_____________;
(2)请写出C2B2与A2B反应的离子方程式,用单线桥法表示电子转移的方向和数目 ____________________________________________________。
(3)元素B、C形成的简单离子中半径较大的是___________(写电子式)。
(4)用电子式表示化合物C2D的形成过程:______________________________________。
(5)化合物M和N,都由A、B、C、D四种元素组成,它们在溶液中相互反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金华市金东区环保部门为了使农村生活垃圾得到合理利用,在全国率先实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
A. 无机物 B. 有机物 C. 盐类 D. 非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中前 4 周期的表格。
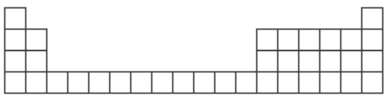
甲是一种常见化合物,其化学式为 XC13。
(1)根据你所学知识,将 X 代表的元素符号,填在所给周期表的表格中对应的位置__________(只写出2 种即可)
(2)若将一种XC13水溶液蒸干、灼烧,得到红棕色粉末 X2O3,则含碳的 X 合金在潮湿的(中性环境)空气中发生电化腐蚀时的正极反应式为__________。
(3)若 X代表另一种金属单质,该单质可与(2)中所述的粉末发生反应,该反应可用于_____。(写出一种用途);该元素的硫酸盐(约1 mol·L-1)和NaHCO3溶液(约1 mol·L-1)及起泡剂制成泡沫灭火剂。使用时发生的化学反应方程式是_______________________________,二者的体积比约是________。泡沫灭火器内的玻璃筒里盛 X 元素的硫酸盐溶液,为什么不能把它盛放在铁筒里________(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙互相分离的最佳方法是( )
A.萃取法 B.升华法 C.蒸馏法 D.分液法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解病得到深蓝色的透明液体;若向试管中加入一定量乙醇,析出深蓝色晶体。结合有关知识,回答下列问题:
(1)Cu、N、O、S元素第一电离能由大到小的顺序是_______(填元素符号);蓝色沉淀溶解时发生反应的离子方程式是________________。
(2)请解释加入乙醇后析出晶体的原因______________。
(3)SO42-的空间构型是_____________,其中S原子的杂化轨道类型是___________。
(4)NH3、H2O分子中,键角的大小顺序为_______(用分子式表示);NH3极易溶于H2O的原因,除了两种分子都是极性分子外,还因为_______________。
(5)Cu和O能形成一种化合物,其晶胞结构如图所示,则R所表示微粒的价电子排布式为_____;若相邻的两不同微粒间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为_______(用含a、NA的代数式表示)g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com