
【题目】洗涤试管内壁上附着的硫黄,可选用的方法是( )
A.用CS2洗涤B.通入H2加热
C.加热试管使硫熔化D.用酒精洗涤
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是 ( )
A.纯净的苯酚是粉红色晶体B.苯酚不溶于水
C.苯比苯酚容易发生苯环上的取代反应D.可用浓溴水鉴别苯和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

如果此方案正确,那么:
(1)操作④为________,操作①、④、⑤都用到的玻璃仪器有____________。
(2)操作②为什么不用硝酸钡溶液,其理由是___________________________________。
(3)进行操作②后,如何判断SO42-已除尽,方法是_______________________________。
(4)操作③的目的是____________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作⑤的目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的0.2g铜粉与5mL1 molL1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________。
A. B.
B. 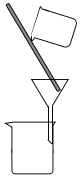 C.
C.![]() D.
D. E.
E. F.
F.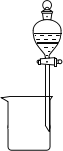
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______(填离子符号),理由是_____________________________________________。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是重要的非金属元素,其化合物在生产、生活中广泛存在。
(1)键能是指在将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
化学键 | N≡N | O=O | N—N | N—H | O—H |
键能/ kJ·mol1 | 946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N—NH2)燃烧生成氮气和气态水的热化学方程式________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
① 该反应为________(填“放热”或“吸热”)反应。
② 乙容器在50min时达到平衡状态,则NO的浓度是____________,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
① A、C两点的浓度平衡常数关系:Kc(A)______Kc(C)(填“<”、“>”或“=”)。
② A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。

③ 计算B点时该反应的压强平衡常数Kp(B)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H为某合成药物的中间体,其合成路线如下:

已知:
① R-CH=CH-CH3 ![]() R-CH=CH-CH2-Br
R-CH=CH-CH2-Br
② RCH=CH2+HBr![]() RCH2CH2Br
RCH2CH2Br
回答下列问题:
(1)A的结构简式为_______。H中含有的含氧官能团名称是__________。
(2)F→G的反应类型为__________,设计C→D的目的为___________。
(3)D→E反应的化学方程式为_____________________________。
(4)M和N与G互为同分异构体。M含有苯环,苯环上有2个支链,且苯环上一氯代物只有2种,遇FeCl3溶液显紫色,能与新制Cu(OH)2悬浊液反应生成砖红色沉淀,则M有_____种(不考虑顺反异构)。N为芳香族化合物,0.5molN与足量银氨溶液反应生成2molAg,核磁共振氢谱显示其峰面积比为1:2:2,则N的结构简式为________。
(5)参考上述合成路线,以丙烯为原料(无机试剂任选)设计制备![]() 的合成路线____________________。
的合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2molA与2molB混合于2L的密闭容器中,发生如下反应,2A(g)+3B(g) ![]() 2C(g)+2D(g),2s后A的转化率为50%,测得v(D)=0.25mol/(L·s)。下列推断不正确的是
2C(g)+2D(g),2s后A的转化率为50%,测得v(D)=0.25mol/(L·s)。下列推断不正确的是
A. z=2
B. 2s后,容器内的压强是初始的7/8倍
C. 2s时,C的体积分数为2/7
D. 2s后,B的浓度为0.5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com