
【题目】我国科学家研发出一种新型的锂离子电池,放电时有关离子转化关系如图所示,下列说法正确的是

A. Li+透过膜除允许Li+通过外,还允许H2O分子通过
B. 放电时,进入贮罐的液体发生反应S2O82-+2Fe2+=2Fe3++2SO42-
C. 充电时,钛电极与外电源的负极相连
D. 充电时,电池内部发生的总反应为Li+ Fe3+=Li+Fe2+
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):

已知:I. 
II. 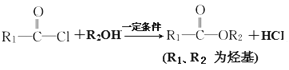
(1)G的名称________
(2)已知E能发生水解反应,则X的结构简式________
(3)C→D的反应类型是_______
(4)光刻胶的结构简式_______________________
(5)B→C第①步反应的化学方程式为_____________________
(6)H与C的分子式相同。满足下列条件的H的结构有_______种。
①分子结构中只有一个羟基,能与FeCl3溶液发生显色反应
②不能发生银镜反应
③分子中除苯环外无其它环状结构
(7)结合以上信息写出以A为原料制备丙三醇的合成路线流程图(其它试剂任选)。______________
合成路线流程图示例如下:CH3CHO![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.氨水应密闭保存于低温处
C.打开汽水瓶时,有大量气泡逸出
D.高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____________。
②浓度均为0.5 mol/L的NaCN和HCN的混合溶液显_________(填“酸”“碱”或“中”)性,通过计算说明:___________________________________。
(2)滤渣1的主要成分是______________(填化学式)。
(3)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____________。
(4)系列操作B为_________________。
(5)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:_______________。
(6)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移向催化剂____________(填“a”或“b”)。
②催化剂a表面发生的反应为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙及其化合物在生产、生活中的应用比较广泛。
回答下列问题:
(1)草酸钙(CaC2O4)常用于陶瓷上釉。将草酸钙溶于强酸可得草酸(H2C2O4),再加入KMnO4溶液发生氧化还原反应。此反应的氧化产物为_____________(填化学式)。
(2)碳酸钙可用于煤燃烧时的脱硫。
已知:反应I :CaCO3(s)=CaO(s)+CO2(g) △H1= +178.3 kJ mol-1;
反应II:CaO(s)+SO2(g)=CaSO3(s) △H2= -402.0 kJ mol-1;
反应III:2CaSO3(s)+O2(g)=2CaSO4(s) △H3= -2314.8 kJ mol-1 △H3= -2314.8 kJ mol-1。
① 反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)的△H=______kJ mol-1。

② 向某恒温密闭容器中加入CaCO3,发生反应I,反应达到平衡后,t1时,缩小容器体积,x随时间(t)的变化关系如图1所示,x可能是____________(任写两个)。
(3)将Ca(OH)2加入Na2WO4碱性溶液中,发生反应IV:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
① 反应IV在较高温度下才能自发进行,则△S_____0(填“>”“=”或“<”,下同),△H_______0。
② T1时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=1×10-8,反应Ⅳ:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
③制取CaWO4时,为了提高WO42-的转化率,常需要适时向反应混合液中添加少量的某种稀酸,该稀酸可能为_______(填选项字母)。
A.稀盐酸 B.稀硝酸 C.稀硫酸 D.碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com