
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
【答案】C
【解析】A、通氧气的一极为正极,通SO2的一极为负极,根据原电池的工作原理,阳离子向正极移动,即H+向B极移动,故A说法正确;B、负极反应式为SO2+2H2O-2e-=SO42-+4H+,正极反应式为O2+4H++4e-=2H2O,因此电池总反应式为:2SO2 + O2 + 2H2O = 2H2SO4,故B说法正确;C、根据选项B的分析,此电极反应式为负极反应式,故C说法错误;D、当有0.25molSO2被吸收,产生H+的物质跌量为4×0.25mol=1mol,转移电子物质的量为0.25×2mol=0.5mol,因此正极消耗的H+的物质的量为0.5mol,因此有0.5molH+通过交换膜,故D说法正确。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:
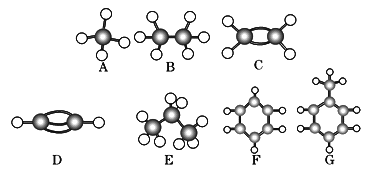
(1)常温下含碳量最高的气态烃是 (填字母).
(2)能够发生加成的烃有 种.
(3)一卤代物种类最多的是 (填写字母).
(4)写出实验室制D的化学方程式 .
(5)写出F发生硝化反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发出一种新型的锂离子电池,放电时有关离子转化关系如图所示,下列说法正确的是

A. Li+透过膜除允许Li+通过外,还允许H2O分子通过
B. 放电时,进入贮罐的液体发生反应S2O82-+2Fe2+=2Fe3++2SO42-
C. 充电时,钛电极与外电源的负极相连
D. 充电时,电池内部发生的总反应为Li+ Fe3+=Li+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素中,按从左到右的顺序,随原子序数的递增,其最高正化合价也递增的是( )
A. 碳、氮、氧、氟 B. 钠、铍、硼、碳
C. 磷、硫、氯、氩 D. 钠、镁、铝、硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
![]()

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含铬废水的方法较多
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:

已知: Cr(OH)3―→NaCrO2―→Na2CrO4―→Na2Cr2O7
请回答:
(1)操作Ⅰ的名称为____________,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有__________。
(2)滤渣Ⅰ的主要成分为________(写化学式),试剂乙的名称为__________。
(3)加入试剂甲的目的是____________________________________________________。
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O![]() 的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,还原Cr2O
的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,还原Cr2O![]() ;③经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生过滤回收沉淀,废水达到排放标准。
;③经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生过滤回收沉淀,废水达到排放标准。
(5) 在②步中,电解法除铬的原理是(写出涉及的主要电极反应式和离子方程式)_____________________________________________________________。
(6)已知某含Cr2O![]() 的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5 mg·L-1。处理该废水1 000 m3并达到排放标准至少消耗铁的质量为________kg。
的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5 mg·L-1。处理该废水1 000 m3并达到排放标准至少消耗铁的质量为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A. 物质的量是含有一定数目粒子的集合体
B. 物质的量是国际单位制中的一个基本物理量
C. 0.012 kg12C中所含的碳原子数为NA
D. 1 mol任何物质都含有约6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯有极强的抗炎和抗氧化活性而起到抗肿瘤的作用。现设计出如下路线合成缓释药物聚咖啡酸苯乙酯:
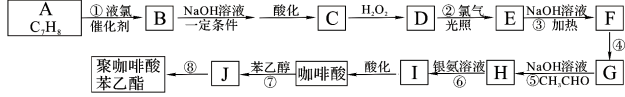
已知:B的核磁共振氢谱有三个波峰;红外光谱显示咖啡酸分子中存在碳碳双键;且:
![]() ;
; ![]()
回答下列各题:
(1)物质B的名称: (系统命名法)。
(2)咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下H2的90倍,含氧质量分数为35.6%,则咖啡酸的分子式为 ;咖啡酸可与NaHCO3溶液反应生成气体,1 mol 咖啡酸与足量钠反应生成1. 5 mol H2,咖啡酸中所有含氧官能团的名称: ;
(3)写出下列反应的类型:④ 、⑧ 。
(4)写出反应③的化学方程式: 。
(5)满足下列条件的咖啡酸的同分异构体有 种。
①含有两个羧基 ②苯环上有三个取代基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com