
【题目】咖啡酸苯乙酯有极强的抗炎和抗氧化活性而起到抗肿瘤的作用。现设计出如下路线合成缓释药物聚咖啡酸苯乙酯:
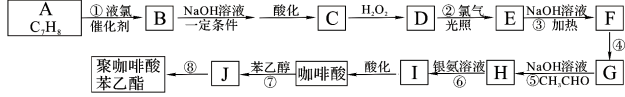
已知:B的核磁共振氢谱有三个波峰;红外光谱显示咖啡酸分子中存在碳碳双键;且:
![]() ;
; ![]()
回答下列各题:
(1)物质B的名称: (系统命名法)。
(2)咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下H2的90倍,含氧质量分数为35.6%,则咖啡酸的分子式为 ;咖啡酸可与NaHCO3溶液反应生成气体,1 mol 咖啡酸与足量钠反应生成1. 5 mol H2,咖啡酸中所有含氧官能团的名称: ;
(3)写出下列反应的类型:④ 、⑧ 。
(4)写出反应③的化学方程式: 。
(5)满足下列条件的咖啡酸的同分异构体有 种。
①含有两个羧基 ②苯环上有三个取代基
【答案】(1)4-氯甲苯;
(2)C9H8O4; 羧基、(酚)羟基;
(3)氧化反应;加聚反应;
(4)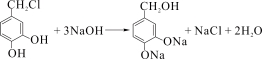 ;
;
(5)6;
【解析】
试题分析:A的名称为甲苯,结构简式为![]() 。
。
(1)甲苯和液氯在催化剂存在时能发生取代反应生成B。由于甲基是邻位、对位取代基,所以取代的氯原子可能在苯环上甲基的邻位、或对位。因为B的核磁共振氢谱有三个波峰。说明有三种氢原子。氯原子在苯环上甲基的对位上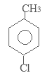 ,名称为4-氯甲苯。
,名称为4-氯甲苯。
(2)4-氯甲苯在NaOH的水溶液中发生反应产生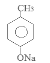 ,酸化后产生C对甲基苯酚
,酸化后产生C对甲基苯酚![]() 。对甲基苯酚被H2O2氧化为D:3,4—二羟基甲苯
。对甲基苯酚被H2O2氧化为D:3,4—二羟基甲苯![]() 。
。![]() 在氯气存在时光照发生取代反应产生E:
在氯气存在时光照发生取代反应产生E: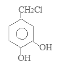 。
。 在加热时与氢氧化钠溶液发生反应产生F:
在加热时与氢氧化钠溶液发生反应产生F: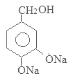 。F在催化剂存在时加热得到G:
。F在催化剂存在时加热得到G: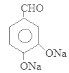 。G与CH3CHO在NaOH溶液中加热发生反应得到H:
。G与CH3CHO在NaOH溶液中加热发生反应得到H: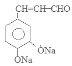 。H与银氨溶液水浴加热反应产生I:
。H与银氨溶液水浴加热反应产生I: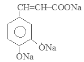 。H酸化得到咖啡酸:
。H酸化得到咖啡酸: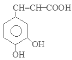 。咖啡酸与苯乙醇发生酯化反应得到J咖啡酸苯乙酯:
。咖啡酸与苯乙醇发生酯化反应得到J咖啡酸苯乙酯: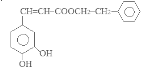 。咖啡酸苯乙酯在一定条件下发生加聚反应产生高聚物聚咖啡酸苯乙酯
。咖啡酸苯乙酯在一定条件下发生加聚反应产生高聚物聚咖啡酸苯乙酯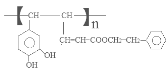 。咖啡酸的相等分子质量为90×2=180,n(O)= (180×35.6%) ÷16=4, 咖啡酸可与NaHCO3溶液反应生成气体,说明含有羧基—COOH;1 mol 咖啡酸与足量钠反应生成1. 5 mol H2,则说明一共含有3个羟基—OH。结合含氧数目及羧基,则应该有1个羧基和2个羟基。根据推导路线、相对分子质量及反应可知咖啡酸的分子式为C9H8O4,结构为
。咖啡酸的相等分子质量为90×2=180,n(O)= (180×35.6%) ÷16=4, 咖啡酸可与NaHCO3溶液反应生成气体,说明含有羧基—COOH;1 mol 咖啡酸与足量钠反应生成1. 5 mol H2,则说明一共含有3个羟基—OH。结合含氧数目及羧基,则应该有1个羧基和2个羟基。根据推导路线、相对分子质量及反应可知咖啡酸的分子式为C9H8O4,结构为 。咖啡酸中所有含氧官能团有羧基、羟基。
。咖啡酸中所有含氧官能团有羧基、羟基。
(3)④的反应的类型为氧化反应;⑧的反应的类型为加聚反应。
(4)反应③的化学方程式 。
。
(5)满足条件①含有两个羧基 ②苯环上有三个取代基的咖啡酸的同分异构体有6种。它们是: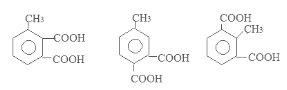
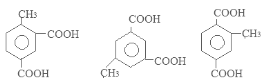 。
。


科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的[FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长__________P-Cl键键长__________(填“>”、“=”或“<”),原因是__________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρgcm-3,设NA为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=_______。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L
(3)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 分液漏斗使用前需要先检查是否漏液
B. 实验中剩余的钠不能再放回原试剂瓶
C. 做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D. 蒸馏烧瓶加热时需要垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应物质的是
A. 只有② B. 只有②④ C. 只有②⑤⑥ D. 只有①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜是一种用途广泛的化工原料,明矾是种常见的净水剂,某校化学兴趣小组探究将一废弃矿石进行处理制备碱式碳酸铜和明矾,从而实现变废为宝。经查资料:该矿石成分为:Al2Fe4CuSi2O13,该化学小组制定工艺流程如下:

己知:Cu2+溶于足量的浓氨水中可形成铜氨溶液:Cu2++4NH3·H2O![]() Cu(NH3)42++4H2O
Cu(NH3)42++4H2O
回答下列问题:
(1)将Al2Fe4CuSi2O13改写成氧化物形式___________;
(2)为了步骤②提高酸浸速率,可采取措施有________,_________(任写两种);
(3)写出步骤⑥的离子方程式__________;
(4)用从滤渣2到明矾需先后加入_____、____两种试剂(按使用顺序填写化学式);
(5)在步骤⑦中,若先加K2CO3溶液,后加KOH溶液,则易发生
CuCO3(s)+2OH-(aq) ![]() Cu(OH)2(s)+CO32-(aq),则该反应平衡常数为:______。(已知:Ksp(CuCO3=2.4×10-10,Ksp(Cu(OH)2=2.2×10-20)。
Cu(OH)2(s)+CO32-(aq),则该反应平衡常数为:______。(已知:Ksp(CuCO3=2.4×10-10,Ksp(Cu(OH)2=2.2×10-20)。
(6)为了检验该碱式碳酸铜纯度,该小组称取25g样品,加入到100mL 3mol/L的盐酸中进行溶解。充分反应后,微热排除CO2,冷却后取出10mL,滴加2滴甲基橙,然后用2mol/L标准KOH溶液进行滴定,共用去5mL。则样品的纯度为_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com