
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=_______。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L
(3)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=______。
【答案】 10-12mol2/L2 10-b-10-a pH=11
【解析】(1)溶液中的离子积Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;故答案为:10-12;
(2)该NaOH溶液中由水电离出的c(OH-)为10-a;则NaOH溶液中NaOH的物质的量浓度为c(NaOH)=c(OH-)=10-bmol/L-10-amol/L=(10-b-10-a)mol/L;故答案为:(10-b-10-a)mol/L;
(3)混合溶液中c(OH-)=![]() mol/L=0.1mol/L,溶液中c(H+)=
mol/L=0.1mol/L,溶液中c(H+)=![]() mol/L=10-11mol/L,则溶液的pH=11,故答案为:11。
mol/L=10-11mol/L,则溶液的pH=11,故答案为:11。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
![]()

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上在合成塔中采用下列反应合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g) △H=Q kJ/mol
CH3OH(g) △H=Q kJ/mol
(1) 下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判△H__________0(填“>”、“<”或“=” ),该反应在________(填“较高”或“较低”)温度下有利于自发进行。
②某温度下,将2mo1CO和6mo1H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0. 2mo1/L,此时对应的温度为________;CO的转化率为_________。
(2) 要提高CO的转化率且提高反应速率,可以采取的措施是__________(填字母序号)。
a、升温 b、加入催化剂 c、增加CO的浓度
d、通入H2加压 e、通入惰性气体加压 f、分离出甲醇
(3) 已知一定条件下,CO与H2在催化剂的作用下生成5molCH3OH时,能量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO 2molH2 | 1molCH3OH | 2molCH3OH | |
平衡 时数 据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应吸收或放出的能量(KJ) | a | b | c | |
体系压强(Pa) | P1 | P2 | P3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是_________________________
A 、2c1>c3 B、a+b<90. 8 C、2P2< P3 D、 α1 +α3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是( )
A.生成物的产量一定增大 B.生成物的百分含量一定增大
C.反应物的浓度一定降低 D.每种反应物的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水中电离的方程式:
(a)氢硫酸_____________________________________________.
(b)碳酸氢钠 ____________________________
(c)硫酸氢钠 ___________________________
(2)写出下列物质水解的离子方程式:
(a)硫酸铝__________ (b)次氯酸钠 ______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯有极强的抗炎和抗氧化活性而起到抗肿瘤的作用。现设计出如下路线合成缓释药物聚咖啡酸苯乙酯:
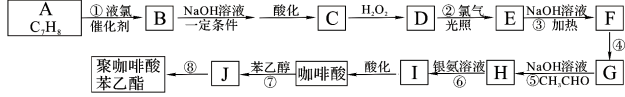
已知:B的核磁共振氢谱有三个波峰;红外光谱显示咖啡酸分子中存在碳碳双键;且:
![]() ;
; ![]()
回答下列各题:
(1)物质B的名称: (系统命名法)。
(2)咖啡酸仅含C、H、O三种元素,蒸气密度是相同条件下H2的90倍,含氧质量分数为35.6%,则咖啡酸的分子式为 ;咖啡酸可与NaHCO3溶液反应生成气体,1 mol 咖啡酸与足量钠反应生成1. 5 mol H2,咖啡酸中所有含氧官能团的名称: ;
(3)写出下列反应的类型:④ 、⑧ 。
(4)写出反应③的化学方程式: 。
(5)满足下列条件的咖啡酸的同分异构体有 种。
①含有两个羧基 ②苯环上有三个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.35g铝用60mL 3mol/L的盐酸完全溶解后,向其中加入200mL 1mol/L的NaOH溶液,可生成沉淀的物质的量为
A. 0.02mol B. 0.03mol C. 0.05mol D. 0.17mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中可用CO2和H2在一定条件下制得烯烃。下图是由煤焦油、CO2和H2合成橡胶和TNT的路线:

请回答下列问题:
(1)工业上煤通过________制取煤焦油。
(2)反应①的反应类型为____________;反应③的反应条件为____________。
(3)烯烃B的名称为________________;E的结构简式为_______________。
(4)D与足量H2在一定条件下反应生成F,F的一氯代物共有_____种。
(5)请写出以CH3COOH、![]() 为原料合成化工产品
为原料合成化工产品 的路线流程图(无机试剂任选)(提示:卤代苯中苯环上的卤原子很难被取代)。
的路线流程图(无机试剂任选)(提示:卤代苯中苯环上的卤原子很难被取代)。
__________合成路线流程图示例如下:


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
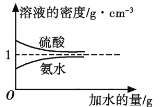
溶质的物质的量浓度/mol·L1 | 溶液的密度/g·cm3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为 (不写单位,用含c1、 ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为 mol·L1。
(3)将物质的量浓度分别为c2 mol·L1和![]() c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度
c2 mol·L1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物质的量浓度 ![]() c2 mol·L1(设混合后溶液的体积变化忽略不计)。
c2 mol·L1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com