
【题目】【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
![]()

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
【答案】(1)3p 3d54s1
(2)> > < <
(3)直线型 sp3
(4)SiH4+2O2=SiO2+2H2O
(5)![]()
【解析】
试题分析:(1)基态铝原子的电子排布为1s22s22p63s23p1,最高能级为3p。基态铬的价电子排布为3d54s1(2)铍原子的电子排布为1s22s2,铍硼的电子排布为1s22s22p1,铍是全满结构,第一电离能大于铍。碳原子半径比硅原子半径小,键长短,键能大。水分子间有氢键,所以水的沸点比硫化氢的高。铝离子与氧离子都有10个电子,核电荷数越大,半径越小。所以铝离子半径小于氧离子半径。(3)氯化铍中铍是sp1杂化,两个键夹角为180度,为直线型;二聚题中铍的杂化轨道类型由单体的sp杂化变为sp3杂化,铍原子提供轨道,氯原子有孤对电子对,。(4)四氢氧化硅在空气中与氧气反应生成二氧化硅和水方程式为:SiH4+2O2=SiO2+2H2O。(5)![]() 。
。
分子 | BeCl2 | BF3 | SiCl4 |
价电子对数 | 2 | 3 | 4 |
几何构型 | 直线型 | 平面三角形 | 正四面体 |
中心原子杂化类型 | sp | sp2 | sp3 |


科目:高中化学 来源: 题型:
【题目】A﹣G是初中化学中常见的物质,其相互反应及转化关系如图所示,部分反应条件省略.已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体.

(1)G的化学式为____________。
(2)写出相应反应的化学方程式:①____________。②____________。
(3)反应③的实验现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙及其化合物在生产、生活中的应用比较广泛。
回答下列问题:
(1)草酸钙(CaC2O4)常用于陶瓷上釉。将草酸钙溶于强酸可得草酸(H2C2O4),再加入KMnO4溶液发生氧化还原反应。此反应的氧化产物为_____________(填化学式)。
(2)碳酸钙可用于煤燃烧时的脱硫。
已知:反应I :CaCO3(s)=CaO(s)+CO2(g) △H1= +178.3 kJ mol-1;
反应II:CaO(s)+SO2(g)=CaSO3(s) △H2= -402.0 kJ mol-1;
反应III:2CaSO3(s)+O2(g)=2CaSO4(s) △H3= -2314.8 kJ mol-1 △H3= -2314.8 kJ mol-1。
① 反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)的△H=______kJ mol-1。

② 向某恒温密闭容器中加入CaCO3,发生反应I,反应达到平衡后,t1时,缩小容器体积,x随时间(t)的变化关系如图1所示,x可能是____________(任写两个)。
(3)将Ca(OH)2加入Na2WO4碱性溶液中,发生反应IV:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
① 反应IV在较高温度下才能自发进行,则△S_____0(填“>”“=”或“<”,下同),△H_______0。
② T1时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=1×10-8,反应Ⅳ:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
③制取CaWO4时,为了提高WO42-的转化率,常需要适时向反应混合液中添加少量的某种稀酸,该稀酸可能为_______(填选项字母)。
A.稀盐酸 B.稀硝酸 C.稀硫酸 D.碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是( )

A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A. 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据
B. X、Y、Z均为气态
C. 上述反应的逆反应的△H>0
D. 使用催化剂Z的产率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:_______________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
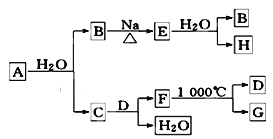
请回答下列问题:
①F的化学式为________,D的电子式为________________。
②E与水反应的化学方程式为___________________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=_______。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L
(3)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com