
【题目】已建立化学平衡的可逆反应,改变条件使化学平衡向正反应方向移动,下列叙述中正确的是( )
A.生成物的产量一定增大 B.生成物的百分含量一定增大
C.反应物的浓度一定降低 D.每种反应物的转化率一定增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钙及其化合物在生产、生活中的应用比较广泛。
回答下列问题:
(1)草酸钙(CaC2O4)常用于陶瓷上釉。将草酸钙溶于强酸可得草酸(H2C2O4),再加入KMnO4溶液发生氧化还原反应。此反应的氧化产物为_____________(填化学式)。
(2)碳酸钙可用于煤燃烧时的脱硫。
已知:反应I :CaCO3(s)=CaO(s)+CO2(g) △H1= +178.3 kJ mol-1;
反应II:CaO(s)+SO2(g)=CaSO3(s) △H2= -402.0 kJ mol-1;
反应III:2CaSO3(s)+O2(g)=2CaSO4(s) △H3= -2314.8 kJ mol-1 △H3= -2314.8 kJ mol-1。
① 反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)的△H=______kJ mol-1。

② 向某恒温密闭容器中加入CaCO3,发生反应I,反应达到平衡后,t1时,缩小容器体积,x随时间(t)的变化关系如图1所示,x可能是____________(任写两个)。
(3)将Ca(OH)2加入Na2WO4碱性溶液中,发生反应IV:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)
CaWO4(s)+2OH-(aq)
① 反应IV在较高温度下才能自发进行,则△S_____0(填“>”“=”或“<”,下同),△H_______0。
② T1时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=1×10-8,反应Ⅳ:WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
CaWO4(s)+2OH-(aq)的平衡常数K=______;请在图2中画出T1下Ca(OH)2和CaWO4的沉淀溶解平衡曲线。
③制取CaWO4时,为了提高WO42-的转化率,常需要适时向反应混合液中添加少量的某种稀酸,该稀酸可能为_______(填选项字母)。
A.稀盐酸 B.稀硝酸 C.稀硫酸 D.碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:_______________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
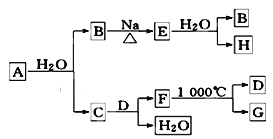
请回答下列问题:
①F的化学式为________,D的电子式为________________。
②E与水反应的化学方程式为___________________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的[FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长__________P-Cl键键长__________(填“>”、“=”或“<”),原因是__________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρgcm-3,设NA为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=_______。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L
(3)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
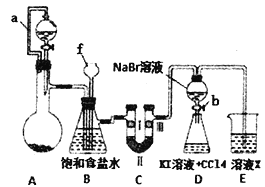
(1)仪器f的名称___________。
(2)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是CrCl3,写出A中离子方程式:________________________________。
(3)B装置的作用除了用来除去氯气中的氯化氢外还有____________。
(4)装置C的作用是探究有氧化性的物质是否一定有漂白性,下列最佳试剂组合是______________
(填序号)
① | ② | ③ | ④ | |
I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
II | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
II! | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 |
(5)利用D装置证明溴的非金属性比碘强的实验操作是:实验完毕,_______,振荡锥形瓶,现象是 _____________________________________________。(补充完整上述实验操作和现象)
(6)D装置进行实验时存在的明显不足是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com