
����Ŀ��ʵ���ǻ�ѧ�о�����Ҫ����֮һ��ijͬѧΪ���Ʊ�������̽�����������ʵ�������ʣ������ͼ��ʾ��ʵ�鷽����
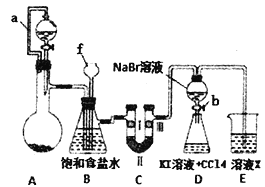
��1������f������___________��
��2��Aװ�õķ�Һ©����ʢװŨ���ᣬ��ƿ�����Ϊ�ظ����(K2Cr207)����ԭ������CrCl3��д��A�����ӷ���ʽ��________________________________��
��3��Bװ�õ����ó���������ȥ�����е��Ȼ������____________��
��4��װ��C��������̽���������Ե������Ƿ�һ����Ư���ԣ���������Լ������______________
������ţ�
�� | �� | �� | �� | |
I | ʪ��ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ʪ��ĺ�ֽ�� |
II | ��ʯ�� | Ũ���� | �轺 | �Ȼ��� |
II! | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� | ����ĺ�ֽ�� |
��5������Dװ��֤����ķǽ����Աȵ�ǿ��ʵ������ǣ�ʵ����ϣ�_______������ƿ�������� _____________________________________________����������������ʵ�����������
��6��Dװ�ý���ʵ��ʱ���ڵ����Բ�����________________________________��
���𰸡� ����©�� Cr2O72-+l4H++6Cl-==2Cr3++3C12��+7H2O ����ȫƿ�����ʵ�������װ���Ƿ���� �� ����b��ʹ����Һ��������ƿ���رջ���b ���D�ֲ㣬�²�Һ����Ϻ�ɫ û���ų��������嵥����KI��Ӧ�ĸ���
����������1������f�����Ƴ���©�� ��(2)�ظ����(K2Cr207)��Ũ����������Cl2�� Cr2O72-+l4H++6Cl-==2Cr3++3C12��+7H2O ����3��װ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������������ʱB�еģ�ѹǿ����B�г���©����Һ���������γ�ˮ������4����װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ���Т٢ڢ۵Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ƣ��轺��P2O5�����������ɫ��������ѡ������5������Dװ��֤����ķǽ����Աȵ�ǿ��ʵ������ǣ�ʵ����ϴ���b��ʹ����Һ��������ƿ���رջ���b������ƿ�������� ���D�ֲ㣬�²�Һ����Ϻ�ɫ ����6��Dװ�ý���ʵ��ʱ���ڵ����Բ����� û���ų��������嵥����KI��Ӧ�ĸ��š�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѽ�����ѧƽ��Ŀ��淴Ӧ���ı�����ʹ��ѧƽ��������Ӧ�����ƶ���������������ȷ���ǣ� ��
A��������IJ���һ������ B��������İٷֺ���һ������
C����Ӧ���Ũ��һ������ D��ÿ�ַ�Ӧ���ת����һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������п���CO2��H2��һ���������Ƶ�ϩ������ͼ����ú���͡�CO2��H2�ϳ���TNT��·�ߣ�

��ش��������⣺
��1����ҵ��úͨ��________��ȡú���͡�
��2����Ӧ�ٵķ�Ӧ����Ϊ____________����Ӧ�۵ķ�Ӧ����Ϊ____________��
��3��ϩ��B������Ϊ________________��E�Ľṹ��ʽΪ_______________��
��4��D������H2��һ�������·�Ӧ����F��F��һ�ȴ��ﹲ��_____�֡�
��5����д����CH3COOH��![]() Ϊԭ�Ϻϳɻ�����Ʒ
Ϊԭ�Ϻϳɻ�����Ʒ ��·������ͼ�����Լ���ѡ������ʾ��±�����б����ϵ�±ԭ�Ӻ��ѱ�ȡ������
��·������ͼ�����Լ���ѡ������ʾ��±�����б����ϵ�±ԭ�Ӻ��ѱ�ȡ������
__________�ϳ�·������ͼʾ�����£�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������辧�����������״�ṹ����ṹ��ͼ��ʾ�����ڶ������辧�������˵������ȷ���ǣ�������
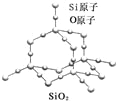
A. ������Si��Oԭ�Ӹ�����Ϊ1��2
B. ������Si��Oԭ������㶼����8���ӽṹ
C. ������һ����ԭ�Ӻ���Si��O����ĿΪ4
D. ��������С���ϵ�ԭ����Ϊ6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ������ͼ��ʾ������Wԭ�ӵ���������������������������������˵������ȷ������ ��

A. ԭ�Ӱ뾶��W>Z>Y>X
B. ����������Ӧˮ�����������X>W>Z
C. �����̬�⻯������ȶ��ԣ�Y>X>W>Z
D. Ԫ��X��Z��W������ϼ۷ֱ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ���͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
��1����̬��ԭ�Ӻ��������________�ֲ�ͬ���˶�״̬����̬��ԭ�ӵļ۲�����Ų�ͼΪ_________��Ԥ����2017�귢������϶������̽�������õij���5�����ػ��ȼ��Ϊƫ������[(CH3)2NNH2]��(CH3)2NNH2��Nԭ�ӵ��ӻ���ʽΪ_________��
��2��������H3BNH3��һ��DZ�ڵĴ�����ϣ������û�����B3N3H6ͨ�����·�Ӧ�Ƶã�3CH4+2B3N3H6+6H2O=3CO2+6H3BNH3
��H3BNH3�������Ƿ������λ��_______________(����������������)��B��C��N��O�ĵ�һ��������С�����˳��Ϊ___________________��
����B3N3H6��Ϊ�ȵ�����ķ�����_____________(��һ������)��B3N3H6Ϊ�Ǽ��Է��ӣ����ݵȵ���ԭ��д��B3N3H6�Ľṹʽ____________________________��
��3�����϶������̽��������̫���ܵ�ذ��ṩ��������̫���ܵ�ذ�����г��������⣬����ͭ�������أ����Ȼ�ѧ���ʣ��ش��������⣺
��SeO3���ӵ����幹��Ϊ_____________��
������ͭͶ�백ˮ��H2O2��Һ�о�����������Ͷ�백ˮ��H2O2�Ļ����Һ�У���ͭƬ�ܽ⣬��Һ������ɫ��д���÷�Ӧ�����ӷ�Ӧ����ʽΪ ��
��ij��ͭ�Ͻ�ľ����ṹ��ͼ��ʾ���þ����о��������ͭԭ�Ӻ͵�ԭ�Ӽ�ľ���Ϊ![]() pm����þ�����ܶ�Ϊ_________________(�ú�a�Ĵ���ʽ��ʾ����NAΪ����٤��������ֵ)��
pm����þ�����ܶ�Ϊ_________________(�ú�a�Ĵ���ʽ��ʾ����NAΪ����٤��������ֵ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ᡢ��ˮ���ܶ�������ˮ�����Ĺ�ϵ��ͼ��ʾ�����������백ˮ��һ�ݣ�����ݱ�����Ϣ���ش��������⣺
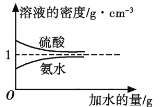
���ʵ����ʵ���Ũ��/mol��L1 | ��Һ���ܶ�/g��cm3 | |
���� | c1 | ��1 |
��ˮ | c2 | ��2 |
(1)�����������������Ϊ (��д��λ���ú�c1�� ��1�Ĵ���ʽ��ʾ)��
(2)���ʵ���Ũ��Ϊc1 mol��L1��������ˮ��������(��Ϻ���Һ������仯���Բ���)��������Һ�����ʵ���Ũ��Ϊ mol��L1��
(3)�����ʵ���Ũ�ȷֱ�Ϊc2 mol��L1��![]() c2 mol��L1�İ�ˮ��������ϣ�������Һ���ܶ� (����ڡ�����С�ڡ����ڡ�����ͬ)��2 g��cm3��������Һ�����ʵ���Ũ��
c2 mol��L1�İ�ˮ��������ϣ�������Һ���ܶ� (����ڡ�����С�ڡ����ڡ�����ͬ)��2 g��cm3��������Һ�����ʵ���Ũ�� ![]() c2 mol��L1(���Ϻ���Һ������仯���Բ���)��
c2 mol��L1(���Ϻ���Һ������仯���Բ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷�Һ©�����Է����һ��Һ���������(����)
A. ��ͱ� B. �Ҵ���ˮ C. ����CCl4 D. ���ͺ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����ѧ��Ӧԭ����ѡ��4����
��1��t��ʱ����2molSO2��1molO2ͨ�����Ϊ2L�ĺ��º����ܱ������У��������·�Ӧ��2SO2 (g)+O2(g)![]() 2SO3(g)����H��-196.6kJ��mol-1��2minʱ��Ӧ�ﵽ��ѧƽ��״̬����ʱ��÷�Ӧ��O2��ʣ��0.8mol����д���пհף�
2SO3(g)����H��-196.6kJ��mol-1��2minʱ��Ӧ�ﵽ��ѧƽ��״̬����ʱ��÷�Ӧ��O2��ʣ��0.8mol����д���пհף�
�� �ӷ�Ӧ��ʼ����ѧƽ��״̬������SO3��ƽ����Ӧ����Ϊ_____����ʱ��Ӧ��O2��ת������___________��
�� ����������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����______�����ţ���ͬ����
A��������ѹǿ���ٷ����仯
B. SO2������������ٷ����仯
C. ����������ԭ���������ٷ����仯
D. ��ͬʱ��������2nmol SO2��ͬʱ����n molO2
��t��ʱ������4mol SO2��2mol O2�Ļ������ͨ���������º����ܱ������У���Ӧ���´ﵽƽ��ʱSO2��ת������� �Ƚ�_______����������������������������С������
��2�����г����µ�������Һ��
��0.1mol/LFeC13 ��Һ��_______��������������������������������)��
�� ʵ����0.1mol/LNaHCO3��ҺpH>7����NaHCO3�ĵ���̶�_______ˮ��̶ȣ�������������������������С��������
�� ��0.10mol/L����ͭ��Һ�м�����������ϡ��Һ��ַ�Ӧ��dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c(Cu2+)=_________����֪Ksp[Cu(OH)2]=2.2��10-2O����
��3������ʵ֤����ԭ����з����ķ�Ӧͨ���Ƿ��ȷ�Ӧ���������з�Ӧ�������Ϊԭ��ص���_________��
A. C(s)+H2O(g)=CO(g)+H2(g) ��H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ��H<0
C.2H2(g)+O2(g)=H2O(l����H<0
�� ��KOH��ҺΪ�������Һ��������ѡ��Ӧ���һ��ԭ��أ���������Ӧʽ��________��
�� ���ԭ���ڹ�ҵ�����Ź㷺��Ӧ�á���ͼ��ʾ�����У�aΪCuSO4��Һ��X��YΪ���Ե缫����Y�缫������Һ��pH�仯��_______��������������������������С������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com