
【题目】工业上在合成塔中采用下列反应合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g) △H=Q kJ/mol
CH3OH(g) △H=Q kJ/mol
(1) 下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判△H__________0(填“>”、“<”或“=” ),该反应在________(填“较高”或“较低”)温度下有利于自发进行。
②某温度下,将2mo1CO和6mo1H2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0. 2mo1/L,此时对应的温度为________;CO的转化率为_________。
(2) 要提高CO的转化率且提高反应速率,可以采取的措施是__________(填字母序号)。
a、升温 b、加入催化剂 c、增加CO的浓度
d、通入H2加压 e、通入惰性气体加压 f、分离出甲醇
(3) 已知一定条件下,CO与H2在催化剂的作用下生成5molCH3OH时,能量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO 2molH2 | 1molCH3OH | 2molCH3OH | |
平衡 时数 据 | CH3OH的浓度(mol·L-1) | c1 | c2 | c3 |
反应吸收或放出的能量(KJ) | a | b | c | |
体系压强(Pa) | P1 | P2 | P3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是_________________________
A 、2c1>c3 B、a+b<90. 8 C、2P2< P3 D、 α1 +α3<1
【答案】 < 较低 250℃ 80% d D
【解析】(1)考查勒夏特列原理、化学反应进行方向、化学平衡的计算,①根据表中数据,随着温度的升高,化学平衡常数减小,即升高温度,平衡向逆反应方向移动,正反应是放热反应,即△H<0,△G=△H-T△S,根据反应方程式,△S<0,要向自发进行,△G<0,即低温下自发进行;②CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始浓度: 1 3 0
变化浓度: 0.8 1.6 0.8
变化浓度:0.2 1.4 0.8 根据化学平衡常数,K= ![]() =2.041,因此此时的温度是250℃;CO的转化率为0.8/1×100%=80%;(2)考查影响化学反应速率的因素和影响化学平衡移动的因素,a、此反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,故a错误;b、加入催化剂,加快反应速率,但对平衡无影响,故b错误;c、增加CO的浓度虽然化学反应速率加快,平衡向正反应方向移动,但CO的转化率降低,故c错误;d、通入氢气,反应物浓度增加,反应速率加快,平衡向正反应方向进行,CO的转化率增大,故d正确;e、通入惰性气体,虽然压强增大,但恒容状态下,组分浓度不变,化学反应速率不变,平衡不移动,故e错误;f、分离出甲醇,平衡向正反应方向移动,CO的转化率增大,但反应速率没有增大,故f错误;(3)本题考查等效平衡,A、依据等效平衡的规律,恒温恒容状态下,反应前后气体系数之和不相等,转化到同一半边,投入量与原平衡投入量相等,即为等效平衡,甲和乙互为等效平衡,即c1=c2,丙可以看作是乙的基础上再加入1molCH3OH,假设平衡不移动,则2c2=c3,再通入1molCH3OH,相当于在原来的基础上增大压强,甲醇的浓度增大, c3>2c2,即c3>2c1,故A错误;B、因为甲和乙为等效平衡,则有a+b=454/5kJ=90.8kJ,故B错误;C、假设平衡不移动,则2P2=P3,当再通入CH3OH,相当于在原来的基础上增大压强,平衡向正反应方向移动,气体物质的量减小,即2P2>P3,故C错误;D、甲和乙为等效平衡,则有α1+α2=1,当再通入CH3OH,相当于在原来的基础上增大压强,平衡向正反应方向移动,甲醇的转化率降低,即α3<α2,因此有α1+α3<1,故D正确。
=2.041,因此此时的温度是250℃;CO的转化率为0.8/1×100%=80%;(2)考查影响化学反应速率的因素和影响化学平衡移动的因素,a、此反应是放热反应,升高温度,平衡向逆反应方向移动,CO的转化率降低,故a错误;b、加入催化剂,加快反应速率,但对平衡无影响,故b错误;c、增加CO的浓度虽然化学反应速率加快,平衡向正反应方向移动,但CO的转化率降低,故c错误;d、通入氢气,反应物浓度增加,反应速率加快,平衡向正反应方向进行,CO的转化率增大,故d正确;e、通入惰性气体,虽然压强增大,但恒容状态下,组分浓度不变,化学反应速率不变,平衡不移动,故e错误;f、分离出甲醇,平衡向正反应方向移动,CO的转化率增大,但反应速率没有增大,故f错误;(3)本题考查等效平衡,A、依据等效平衡的规律,恒温恒容状态下,反应前后气体系数之和不相等,转化到同一半边,投入量与原平衡投入量相等,即为等效平衡,甲和乙互为等效平衡,即c1=c2,丙可以看作是乙的基础上再加入1molCH3OH,假设平衡不移动,则2c2=c3,再通入1molCH3OH,相当于在原来的基础上增大压强,甲醇的浓度增大, c3>2c2,即c3>2c1,故A错误;B、因为甲和乙为等效平衡,则有a+b=454/5kJ=90.8kJ,故B错误;C、假设平衡不移动,则2P2=P3,当再通入CH3OH,相当于在原来的基础上增大压强,平衡向正反应方向移动,气体物质的量减小,即2P2>P3,故C错误;D、甲和乙为等效平衡,则有α1+α2=1,当再通入CH3OH,相当于在原来的基础上增大压强,平衡向正反应方向移动,甲醇的转化率降低,即α3<α2,因此有α1+α3<1,故D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A. 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据
B. X、Y、Z均为气态
C. 上述反应的逆反应的△H>0
D. 使用催化剂Z的产率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:_______________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
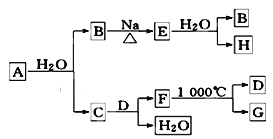
请回答下列问题:
①F的化学式为________,D的电子式为________________。
②E与水反应的化学方程式为___________________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:2 SO2 (g)+O2 (g)![]() 2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
2SO3(g) △H<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(2)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:
N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为1 L。
2NH3(g),起始时A、B的体积相同均为1 L。

①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_____。

②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(3)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为_______ (用c1、c2、c3和>、<、=表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=_______。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L
(3)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com