
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18 g·cm-3
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_______。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)等于________mol/L
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积是 L。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮元素是造成水体富营养化的主要原因,在水中常以氨氮或NO3形式存在。
(1)在pH为4~6时,用H2在Pd-Cu催化下将NO3-还原为N2可消除水中NO3。该反应的离子方程式为____。若用H2和CO2的混合气体代替H2,NO3-去除效果更好,其原因是____。
(2)NaClO氧化可除去氨氮,反应机理如图1所示(其中H2O和NaCl略去),实验测得相同条件下,相同反应时间,pH与氨氮的去除率关系如图2所示,温度与氨氮去除率关系如图3所示。



图1 图2 图3
①NaClO氧化NH3的总反应的化学方程式为____。
②如图2所示,在pH>9时,pH越大去除率越小,其原因是____。
③如图3所示,温度低于15℃时,温度越低去除率越低其原因是____。当温度高于25℃时,温度越高去除率也越低,其原因是____。
(3)用电化学法可去除废水中的氨氮。在含NH4+的废水中加入氯化钠,用惰性电极电解。反应装置如图4所示,则电解时,a极的电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、![]() 、酒精、NaCl溶液,振荡后静置,现象正确的是
、酒精、NaCl溶液,振荡后静置,现象正确的是![]()
![]()
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈黄褐色D.Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出方程式:实验室制乙炔__________________;
(2)![]() 该有机物共面的原子最多有_____个,与溴发生加成反应的产物最多有_______种
该有机物共面的原子最多有_____个,与溴发生加成反应的产物最多有_______种
(3)有甲、乙两种物质:

由甲转化为乙需经下列过程(已省略去各步反应的无关产物)
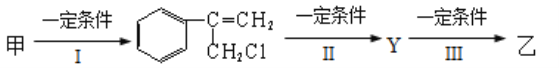
①反应I的反应类型是__________________,
②反应II的条件是_________________________________,
③反应III的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
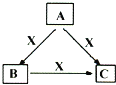
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为____________________________________________。
(2)1 mol CH2=CH-CH2OH中σ键和π键的个数比为___________,丙烯醇分子中碳原子的杂化类型为___________。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是______________________。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。[Ni(NH3)6]2+中心原子的配位数是___________ ,与SCN-互为等电子体的分子为___________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___________。
②已知:氧化镍晶胞密度为dg/cm3,NA代表阿伏加德罗常数的值,则Ni2+半径为___________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某铜器表面Cux(OH)yClz(Cu为+2价,x、y、z为正整数)的组成,现进行如下实验:取少量Cux(OH)yClz,将其完全溶解于稀硝酸中,将所得溶液分成两等份。向其中一份滴加足量AgNO3溶液,将所得沉淀过滤、洗涤、干燥,得到固体0.1435 g。向另一份中加入0.1000 mol·L1 EDTA(已知Cu2+与EDTA反应的化学计量数比为1∶1),恰好完全反应时消耗EDTA 20mL。则Cux(OH)yClz的化学式中y的值为( )
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。
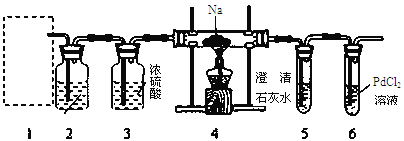
回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用____装置(填下图字母代号),如何检验所选装置的气密性_____。
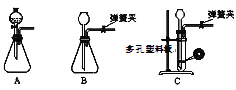
(2)装置2中所盛试剂为_______。
A.NaOH溶液 B.饱和NaHCO3溶液
C.饱和Na2CO3溶液 D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到_____现象时,再点燃酒精灯,这步操作的目的是________。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净____。
②该探究得出钠与二氧化碳反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空:
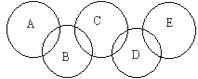
(1)写出下列物质的化学式:A_____,B_____,D_____。
(2)写出下列反应的离子方程式:B+C:_____________________。
(3)相连环物质间发生的反应中,氧化还原反应共有___________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com