
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计 ______(填“合理”或“不合理”),理由是______。
。此设计 ______(填“合理”或“不合理”),理由是______。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
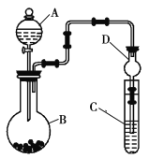
(1)仪器A的名称为______,干燥管D的作用是______。
(2)实验室中现有药品:![]() 溶液、
溶液、![]() 、浓盐酸、
、浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为______、______、______,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______。
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为______、______、______,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______。
(3)若要证明非金属性:![]() ,则A中加______,B中加
,则A中加______,B中加![]() ,C中加______,观察到C中的现象为______。
,C中加______,观察到C中的现象为______。
【答案】不合理 N为活泼非金属元素,不表现金属性 分液漏斗 防止倒吸 浓盐酸 ![]()
![]() 溶液 S2-+Cl2═S↓+2Cl- 稀硫酸
溶液 S2-+Cl2═S↓+2Cl- 稀硫酸 ![]() 溶液 有白色沉淀产生
溶液 有白色沉淀产生
【解析】
Ⅰ.N元素为活泼非金属元素,不表现金属性;
Ⅱ.(1)根据仪器的构造写出仪器A的名称;球形干燥管具有防止倒吸的作用;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;
(3)要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明。
Ⅰ.将NaOH溶液与NH4Cl溶液混合生成NH3H2O,可以说明NaOH的碱性大于NH3H2O,但不能说明Na的金属性大于N,因为N元素为活泼非金属元素,不表现金属性,故答案为:不合理;N为活泼非金属元素,不表现金属性;
Ⅱ.(1)由实验装置图可知仪器A称为分液漏斗,球形干燥管D能够防止溶液倒吸,避免试管C中液体进入锥形瓶中,影响实验,故答案为:分液漏斗;防止倒吸;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,烧瓶中发生反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2+8H2O,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2-+Cl2═S↓+2Cl-,
故答案为:浓盐酸;KMnO4;Na2S溶液;S2-+Cl2═S↓+2Cl-;
(5)若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中为Na2CO3溶液,则A中试剂应为没有挥发性的稀硫酸,稀硫酸和碳酸钠反应生成CO2, CO2通入到C中,与Na2SiO3溶液反应生成硅酸白色胶状沉淀,反应的离子方程式为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,产生,反应证明酸性:H2CO3>H2SiO3,则非金属性:C>Si,故答案为:稀硫酸;Na2SiO3溶液;有白色胶状沉淀产生。


科目:高中化学 来源: 题型:
【题目】“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(Ⅰ)打开这种药片的密封膜,发现其外观为淡黄色;
(Ⅱ)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(Ⅲ)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(Ⅳ)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
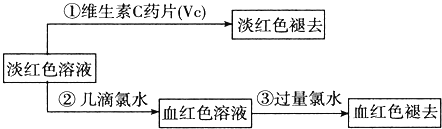
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是 ______ ,另一同学判断出错的原因是 ______ .
(2)丙的实验①说明维生素C具有较强的 ______ 性![]() 填“氧化”或“还原”
填“氧化”或“还原”![]() .
.
(3)写出与丙的实验②中现象对应的离子反应方程式 ______;______ .
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理 ______ .
(5)针对实验目的,本次实验尚未完成的任务是 ______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是两种具有相同分子式的有机物—邻羟基苯甲酸和对羟基苯甲酸的结构式。已知它们的沸点相差很大,你认为哪一种沸点较高?______________,如何从氢键的角度来解释?______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
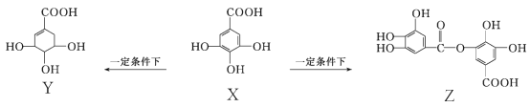
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把河沙(主要成分是![]() )与镁粉按一定质量比(质量比略大于
)与镁粉按一定质量比(质量比略大于![]() )混合均匀,装入试管中加热大约
)混合均匀,装入试管中加热大约![]() 后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下发生反应的化学方程式:______。
(2)生成的混合物放入稀硫酸中,产生的气体是______(填分子式)。
(3)用化学方程式表示产生“爆炸声”的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于周期表的说法正确的是( )
A.C和Si属于第ⅣA族元素,SiH4比CH4稳定
B.N和B属于第二周期元素,原子半径:N>B
C.S和Cl属于第三周期元素,其含氧酸的酸性:H2SO4<HClO3
D.某元素氢化物的化学式为RH3,则其最高价氧化物的水化物可能为HRO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率、化学反应限度的说法中,正确的是( )
A.反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B.用铁片与稀硫酸反应制H2,改用 98%的浓硫酸可加快生成H2的速率
C.反应2SO2(g)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
D.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 L0.1 mol·L-1 氨水中含有0.1NA NH3分子
B.46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g14C所含中子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用符号表示下列核素或同位素。
(1)质子数为![]() ,中子数为
,中子数为![]() 的
的![]() 原子:______。
原子:______。
(2)质子数和中子数都为9的氟原子:______。
(3)中子数为2的氢原子:______。
(4)中子数分别为8、9、10的氧原子:______。
(5)质量数分别为35、37的氯原子: ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com