
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
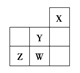
A. Y的原子半径在同周期主族元素中最大
B. W的非金属性比Z的弱
C. Z的气态氢化物的稳定性在同主族元素中最强
D. W的最高价氧化物对应的水化物是强酸
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ,操作2是 、过滤,副产品主要成分的化学式为 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 。
(3)已知钛的还原性介于铝与锌之间,估计钛能耐腐蚀的原因之一是 。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是 。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是( )。
A. 可用25mL碱式滴定管量取20.00mL KMnO4溶液
B. 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C. 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O的装置和部分操作步骤如图所示。
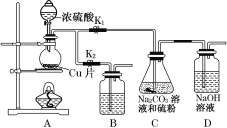
Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①步骤Ⅰ中,圆底烧瓶内发生反应的化学方程式是_________________。
②步骤Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是____________。“停止C中的反应”的操作是____________________________________。
③装置B中盛放的试剂是________溶液(填化学式),其作用是___________________。
(2)依据反应2S2O+I2=S4O+2I-,可用I2的标准溶液测定产品的纯度。取5.5 g产品,配制成100 mL溶液。取10 mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol·L-1的标准溶液进行滴定,相关数据记录如表所示。
编号 | 1 | 2 | 3 | 4 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
①判断达到滴定终点的现象是__________________________________________。
②Na2S2O3·5H2O(式量M=248)在产品中的质量分数是(计算结果保留1位小数)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同),其原子结构示意图为 。元素K名称为 在周期表中的位置 。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是: 。]
(3)某元素二价阳离子的核外有10个电子,该元素是 (填元素名称)
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序 。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是 。
(7)元素I的氢化物的结构式为 ;该氢化物常温下和元素K的单质反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮锌镀层厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放人6 mol.L-1 NaOH溶液中,当石墨棒上不再有气泡产生时,取出铁片,用水冲洗、烘干后称量,得质量为m2 。下列说法正确的是
A.设锌镀层厚度为h,锌的密度为ρ,则![]()
B.锌电极的电极反应式为2H2O+2e-==H2↑+2OH-
C.锌和石墨在碱溶液中形成原电池,外电路中电流从锌流向石墨
D.当石墨上不再有气泡时,立即取出铁片,冲洗后用酒精灯加热烘干,铁片可能部分被氧化,导致实验结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含有的较少的H+和OH-):Na+、NH4+、SO42-、CO32-、NO3-。取200 mL该溶液,分为两等份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+) ≥ 0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容器可变的密闭容器中,反应N2(g)+3H2(g)![]() 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______(选填“增大”、“减小”,下同),v逆______,平衡向______方向移动(选填“正反应”、“逆反应”)。
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为______反应(选填“吸热”、“放热”)。
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______(填写编号)。

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______(选填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则
pC(g),达到平衡后,当升高温度时,B的转化率减小;当减小压强时,混合体系中A的质量分数增大,则
(1)该反应的正反应是__________热反应,且m+n__________p (填“>”、“<”或“=”)。
(2)增大压强时,B的转化率__________(填“增大”、“减小”或“不变”,下同),逆反应速率__________。
(3)若加入C(体积不变),则A的体积分数__________。
(4)若降低温度,则平衡时B、C的浓度之比c(C)/c(B)比值将________。
(5)若加入催化剂,该反应的反应热________。
(6)若B是有色物质,A、C均为无色物质,维持容器体积不变,充入氖气时,混合气体的颜色__________(填“变浅”、“变深”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com