
【题目】如图图示与对应的叙述相符的是( ) 
A.图甲表示反应:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2 , K1>K2
B.图乙表示压强对可逆反应2A(g)+2B(g)3C(g)+D(g)的影响,乙的压强比甲的压强大
C.图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
【答案】D
【解析】解:A、由图甲可知,CO的起始物质的量相同时,该反应为放热反应,降低温度平衡向正反应移动,温度越低,氮气的含量更高,故温度T1<T2 , 温度越高化学平衡越低,故K1>K2 , 故A错误;
B、对于2A(g)+2 B(g)3C(g)+D(g),压强的改变不仅影响反应速率,而且平衡也发生移动,故B错误;
C、催化剂不影响反应的焓变,故C错误;
D、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应,所以该反应的△H<0,故D正确;
故选D.
【考点精析】通过灵活运用反应热和焓变和化学平衡状态本质及特征,掌握在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )
A. 溶液中Na+浓度增大,有O2放出B. 溶液碱性不变,有H2放出
C. 溶液中Na+数目减少,有O2放出D. 溶液碱性增强,有O2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL密度1.31g/cm3、质量分数为15%的硫酸与适量的铁屑充分反应.计算:
(1)此硫酸溶液中H2SO4的物质的量浓度;
(2)生成的H2的体积(标况);
(3)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过你的观察和推理,判断下列实验室中对于少量钠的保存方法正确的是( )
A. 保存在水中B. 密封,保存在细口瓶中
C. 用铝箔包裹,密封在广口瓶中D. 密封,保存在广口瓶中的煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是
A. 钠的化合物B. 可与硝酸反应C. 可溶于水D. 电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,汽车尾气已成为许多大城市空气的主要污染源。汽车尾气中含有CO、NO等多种污染物。
(1)汽车燃料中一般不含氮元素,尾气中所含的NO是如何产生的?说明原因并写出有关反应的化学方程式:__________________________________________________。
(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是____________________.。
(3)下列措施中,能减少或控制汽车尾气污染有效且可行的是__________。
①制定严格的汽车尾气排放标准,并严格执行。
②开发清洗能源汽车,如氢能汽车、太阳能汽车等。
③市民出行戴防护面具。
④市民大量移居城市郊区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验.试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色).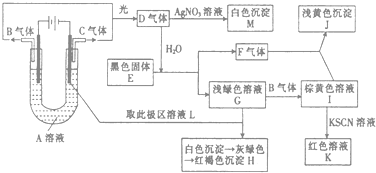
(1)A的化学式为 , E的名称为 .
(2)I和F反应的离子方程式是 .
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是 , 阳极的电极反应式为 , 阴极的电极反应式为 , 电解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物分别是NaOH、NH3H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①0.001mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B<D;
③E是弱电解质.回答下列问题:
(1)D是溶液,判断理由是 .
(2)用水稀释0.1molL﹣1 B时,溶液中随着水量的增加而减小的是(填写序号).
① ![]() ②
② ![]() ③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
③c(H+)和c(OH﹣)的乘积 ④OH﹣的物质的量
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的曲线(填写序号).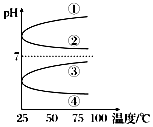
(4)OH﹣浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是(填写序号).
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌的物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌剩余
⑥E溶液里有锌剩余.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com