
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/℃ |
1266 |
1534 |
183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L∙ min。
(1)AC
(2)BeCl2+2H2O  Be(OH)2+2HCl
Be(OH)2+2HCl
(3)B、E
(4)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高。(2分 )
正四面体 (1分),相等(1分)
(5)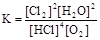 (1分)
0.0625mol/L∙ min (1分)
(1分)
0.0625mol/L∙ min (1分)
【解析】
试题分析:(1)判断氧和氟非金属性强弱可依据气态氢化物的稳定性,由于氟没有最高价氧化物对应水化物,故不能通过酸性比较,还可通过单质与氢气反应的难易判断,非金属单质一般不会与酸发生反应,故不可。选AC。
(2)BeCl2是一种强酸弱碱盐,其水解反应的化学方程式BeCl2+2H2O
 Be(OH)2+2HCl
。
Be(OH)2+2HCl
。
(3)A.铝单质与CuSO4溶液发生置换反应。B.Fe2O3 不能发生。 C.浓硫酸发生钝化。 D.NaOH与铝生成偏铝酸钠和氢气。 E.Na2CO3固体与铝不发生反应。故常温下,不能与发生反应的是B、E。
(4)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高。SiF4发生SP3杂货,分子的空间构型为正四面体,SiF4中Si—F键间的键角相等。
(5)反应4HCl+O2  2Cl2+2H2O,的平衡常数的表达式
2Cl2+2H2O,的平衡常数的表达式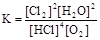 ;则HCl的平均反应速率为(2.5mol-2.25mol)/(2L*8min)= 0.0625mol/L∙
min。
;则HCl的平均反应速率为(2.5mol-2.25mol)/(2L*8min)= 0.0625mol/L∙
min。
考点:本题考查元素非金属性强弱判断,晶体熔沸点判断,化学反应速率的计算等。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市四区(杨浦、青浦、宝山、静安)高三下学期二模化学试卷(解析版) 题型:填空题
回答以下关于第三周期元素及其化合物的问题。
(1)Na原子核外共有 种不同运动状态的电子,有 种不同能量的电子。
(2)相同压强下,部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/℃ |
1266 |
1534 |
183 |
试解释上表中氟化物熔点差异的原因: 。
(3)SiF4分子的空间构型为 ,SiF4中Si—F键间的键角是 。
(4)在P、S、Cl三种元素形成的氢化物中,热稳定性最大的是 (填氢化物的化学式);
已知Na的原子半径大于Cl的原子半径,其原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com