
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:
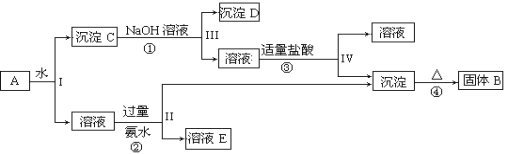
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式B_________;沉淀D __________;溶液E__________。
(3)写出①、②、③、④四个反应方程式或离子方程式:
①___________________________________;
②___________________________________;
③___________________________________;
④___________________________________。
【答案】过滤 Al2O3 Fe2O3 (NH4)2SO4 ,K2SO4,( NH3·H2O) Al2O3 + 2NaOH = 2NaAlO2 +H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ AlO2-+H2O+H+ =Al(OH)3↓ 2Al(OH)3![]() Al2O3 +3H2O
Al2O3 +3H2O
【解析】
由流程可知,Al2O3和Fe2O3不溶于水,则沉淀C为Al2O3和Fe2O3,氧化铁与碱不反应,则沉淀D为Fe2O3,反应②③中生成的沉淀为Al(OH)3,受热分解生成B为Al2O3,反应②为KAl(SO4)2、氨水的反应,则溶液E为K2SO4、(NH4)2SO4、和过量的NH3·H2O,生成的沉淀为Al(OH)3,然后结合物质的性质及化学用语来解答。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离方法为过滤,故答案为:过滤;
(2)由上述分析可知,B为Al2O3,D为Fe2O3,E为K2SO4、(NH4)2SO4、NH3·H2O;
(3)①根据分析可知该反应为:Al2O3+2OH-=2AlO2-+H2O;
②为KAl(SO4)2和氨水的反应,氨水为弱碱不和氢氧化铝沉淀反应,所以方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
③为偏铝酸钠溶液中滴加少量盐酸,方程式为:AlO2-+H2O+H+ =Al(OH)3↓;
④为加热氢氧化铝沉淀,方程式为:2Al(OH)3![]() Al2O3 +3H2O。
Al2O3 +3H2O。


科目:高中化学 来源: 题型:
【题目】“连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示。下列有关该有机物的说法错误的是( )
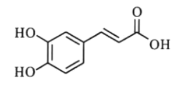
A.分子式为C9H8O4
B.分子中所有原子可能处于同一平面
C.1mol该分子最多可与5molH2发生加成反应
D.能与NaHCO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气
(1)求生成氯气的体积_________(标准状况)
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成白色沉淀57.4g,求原浓盐酸的物质的量浓度_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷在工业、农业、医学等领域用途非常广泛。回答下列问题:
⑴确定砷华(成分为 As2O3)是晶体还是非晶体,可通过______________加以确定。
⑵基态砷原子的价电子排布式为 ______________。
⑶ AsH3 空间构型为___________,NH3 沸点比 AsH3 高,其原因为__________________;药物胂凡纳明(![]() )分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
)分子中,共价键的类型有________ , 原子采用 sp2 杂化的有_____。
⑷砷酸(H3AsO4)的酸性比亚砷酸(H3AsO3)_______(填“强”或“弱”),其理由是 ______________。
⑸最近我国科学家研制的一种“稀磁材料”,其晶胞结构如下图所示。与 Zn 原子紧邻的 Zn 数目为_________个, 该晶体的密度为 _____________ g·cm-3(不必计算结果,写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喝茶,对很多人来说是人生的一大快乐,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。结构简式如下:
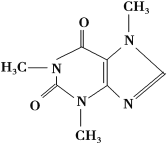
实验室可通过下列简单方法从茶叶中提取咖啡因:

(1)咖啡因的分子式为___________________________________________。
(2)步骤1浸泡茶叶所用的溶剂最好为________。
A.水 B.酒精 C.石油醚
(3)步骤1、步骤4所进行的操作或方法分别是________,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应2A![]() B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
B(g) +C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A. 正反应是吸热反应,且A不是气态
B. 正反应是放热反应,且A是气态
C. 其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成的一种化合物M具有如图性质,下列推断正确的是

A.原子半径:Z>Y>X>W
B.最高价氧化物对应的水化物酸性:Y>X
C.W、Y、Z组成的化合物只含共价键
D.W分别与X、Y、Z组成的二元化合物都易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
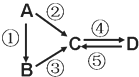
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com