
下列叙述不正确的是
A.标况下,混合气体的平均分子量可表示为22.4·混合气体的平均密度
B.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
C.1.0L1mol/L的NaOH溶液中所含氧原子数为1NA
D.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
科目:高中化学 来源:2015-2016学年河南省高一上学期二次月考化学试卷(解析版) 题型:选择题
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 m~10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市四校高二上学期期中联考化学试卷(解析版) 题型:填空题
(1)常温下将0.2 mol•L?1 HCl溶液与0.2 mol•L?1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2 mol•L?1HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②混合溶液中c(Cl-)-c(M+)= mol•L?1。(填精确计算结果)
(2)常温下若将0.2 mol•L?1 MOH溶液与0.1 mol•L?1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,若溶液的pH不等于7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000 mol•L?1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
实验序号 | 0.1000 mol•L?1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 20.00 |
2 | 25.53 | 20.00 |
3 | 27.85 | 20.00 |
①待测NaOH溶液的物质的量浓度为 mol•L?1。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期9月教学质检化学试卷(解析版) 题型:填空题
某同学按下列步骤配制500mL 0.200mol/L KCl 溶液:
①将烧杯中的溶液转移至500mL 容量瓶中 ②称量KCl 固体 ③向容量瓶中加蒸馏水至刻度线 ④计算所需KCl的质量 ⑤将KCl加入100mL 烧杯中,并加适量水
(1)④计算所需要KCl 的质量为 ;
(2)实验的先后顺序应为 (填写序号);
(3)在 ①实验中,为防止溶液溅出,应采取的措施是 ;
(4)在进行 ③的实验操作时应注意的问题是 ;
(5)在进行 ⑤时,为了加快溶解速率,可以采取的措施是 .
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是
A.容量瓶内有水,未经过干燥处理
B.定容时,俯视刻度线
C.移液完成后,溶解KCl的烧杯未用蒸馏水洗涤
D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期9月教学质检化学试卷(解析版) 题型:选择题
利用下述方法除去氮气中所含的杂质(HCl,H2,H2S)以得到干燥纯净氮气,在下列各步中应采用的正确顺序是
①通过装有变色硅胶的干燥管 ②通过氢氧化钠溶液 ③通过加热的氧化铜
A.①②③③ B.②①③① C.②③③① D.③②①③
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期9月月考理综化学试卷(解析版) 题型:实验题
亚硝酸盐是一种常见的食品添加剂,使用时必须严格控制其用量。为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计,假定食品本身不参与反应),某研究小组设计了如下实验方案:

(1)实验过程中需配制500 mL 0.0010 mol/L (NH4)2Fe(SO4)2标准溶液,如下图所示的仪器中肯定不需要的是 (填序号),配制上述溶液还需要用到的玻璃仪器是 (填仪器名称)。配制溶液时,定容的操作方法是 。

(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,则亚硝酸的电离方程式为 .
(3)完成并配平实验方案中反应①的离子方程式,并用单线桥表示电子转移的方向和数目:
□MnO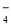 + □ NO
+ □ NO + □
+ □  □ Mn2+ + □ NO
□ Mn2+ + □ NO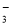 + □ ,
+ □ ,
(4)若称取样品a g进行测定,准确量取12.00 mL 0.0005 mol/L的酸性KMnO4溶液(过量)与溶液
A反应。反应后溶液用0.0010 mol/L (NH4)2Fe(SO4)2 标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则1 kg样品中 NaNO2的质量为_______mg (用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期期中测试化学试卷(解析版) 题型:计算题
现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)求消耗得锌的质量为多少克?
(2)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(3)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?(Zn+2HCl = ZnCl2+H2)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省宜昌市高一上学期期中测试化学试卷(解析版) 题型:选择题
已知M2O7x一+3S2一+14H+ 2M3++3S↓+7H2O,则M2O7x一中的M的化合价为
2M3++3S↓+7H2O,则M2O7x一中的M的化合价为
A.+2 B.+3 C. +4 D.+6
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:填空题
K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6]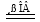 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
2 (CN)2↑+12 KCN +N2↑+ Fe3C + C
(1)K4[Fe(CN)6]中Fe2+的配位数为 (填数字);Fe2+基态核外电子排布式为 。
(2)(CN)2分子中碳原子杂化轨道类型为 ;1mol(CN)2分子中含有 键的数目为 。
键的数目为 。
(3)O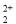 与CN
与CN 互为等电子体,则O
互为等电子体,则O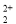 的电子式为 。
的电子式为 。
(4)Fe3C的晶胞结构中碳 原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com